Составим уравнение реакции:
2Na + 2HCl=2NaCl+ H2
Найдем кол-во в-ва натрия (n(Na))
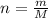
M(Na)=23 г/моль
n(Na)=69г./23г/моль=3моль
Тогда n(H2)=1.5моль
m(H2)=1.5моль*2г/моль=3 г.
V=n*Vm
Vm=22.4 л/моль
V(H2)=1.5 моль * 22,4 л/моль=33,6 л
ответ:m(H2)=3 г.
V(H2)=33,6 л
Сразу запишем уравнение 2Na+2HCl=2NaCl+H2... Найдём химическое кол-во натрия n(Na)=69/23=3моль. По уравнению перейдём к хим. количеству водорода n(H2)= 1,5 моль. Теперь найдём массу m(H2)=n*M=1,5*2=2г и объём V(H2)=n*Vm=1,5*22,4=33,6л