Ира окажется права, так как берётся раствор бромида никеля, значит в нём содержится вода. Калий - представитель активных металлов, он и будет в первую очередь взаимодействовать с водой:
2K + 2H₂O --> 2KOH + H₂
Далее, бромид никеля, скорее всего будет взаимодействовать с калиевой щелочью:
2KOH + NiBr₂ --> Ni(OH)₂↓ + 2KBr
И получит Андрей по итогу светло-зелёный осадок гидроксида никеля (II), но никак не сам металл - никель. Что его получить, нужно было взять, например, цинк.
Zn + NiBr₂ --> Ni + ZnBr₂
Сера взаимодействует с водой при нагрвании при этом диспропорционирует до степеней окисления -2 и +6 в соответствующие кислоты. В серной кислоте сера шестивалентна (образует 6 связей), в сероводороде двухвалентна.
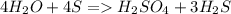
Как ни странно, водород быть окислителем, например, в реакции с щелочным металлом с образованием гидрида металла.
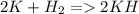
Более активные металлы вытеснять из соединений менее активные металлы:
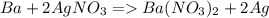
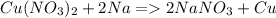
А вот взаимодействие между свинцом и сульфидом калия невозможно. Свинец слабее калия, поэтому не вытесняет его из соединения. Если рассматривать сульфид, как восстановитель, то и тут ничего хорошего не получается, поскольку свинец, как и всякий металл неустойчив в отрицательных степенях окисления. Возможно вы имели в виду соль свинца. С солью реакция пойдет как обычный ионный обмен:
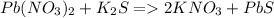
Дано:
m р-р ( AgNO3 ) = 80 г
Массовая доля р-в (NaCl) = 2%=
= 0,02
m ( выпавшего осадка ) = ?
AgNO3 + NaCl = AgCl ( вып. ос. ) + NaNO3
n = 1 моль n = 1 моль
M = 108 +14 + 32 = M = 108 + 35 = 143 г/моль
= 132 + 32 = 164 г/моль m = 143 г
m = 164 г
1) m р-в ( NaCl ) = 0,02 * 80 = 1,6
2) 80 делим на 164 = икс делим на 143.
Крест на крест, икс = 80 * 143 и делим на 164 = 70 г