m(AI)=108г.
m[AI₂(SO₄)₃]-?
1.Определим молярную массу алюминия и его количество вещества в 108г.:
M(AI)=27г./моль
n(AI)=m(AI)÷M(AI)=27г./моль
n(AI)=108г.÷27г./моль=4моль
2. Запишем уравнение реакции:
2AI + 3H₂SO₄= AI₂(SO₄)₃ + 3H₂
по уравнению реакции 2 моль алюминия образуется 1 моль сульфата алюминия;
по условию задачи: 4моль алюминия образуется 2 моль сульфата алюминия; n₁[AI₂(SO₄)₃=2моль
4. Определим молярную массу сульфата алюминия и его массу количеством вещества 2моль:
M[AI₂(SO₄)₃]=54+96+192=342 г./моль
m[AI₂(SO₄)₃]=n₁[AI₂(SO₄)₃хM[AI₂(SO₄)₃]
m[AI₂(SO₄)₃]=2мольх342 г./моль=684г.
5. ответ: при взаимодействии 108г. алюминия с раствором серной кислоты образуется 684г. сульфата алюминия.
№1:
а - 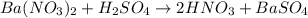
б - 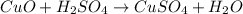
в - 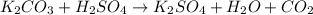
г - 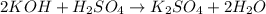
Про тесения реакций - извини, не очень понял, что требуется?
№3
Качественная реакция на сульфат - анион есть реакция с катионами бария: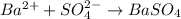 - выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
- выпадает белый осадок сульфата бария, такая реакция есть в задании №1 под пунктом - а
№4 В обе пробирки добавить несколько мл гидроксида бария. В пробирке с соляной кислотой пройдет обычная нейтрализация, видимых изменений не наблюдается, а в пробирке с серной кислотой выпадет белый осадок сульфата бария(ионные уравнения приведены выше)
Дано:
n(NaOH) = 0,6 моль
Найти:
n(P2O5)
х моль 0,6 моль
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
1 моль 6 моль
х моль 0,6 моль
1 моль 6 моль
х = 1 моль ∙ 0,6 моль\6 моль = 0.1 моль
ответ: n(P2O5) = 0,1 моль