1) 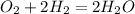
1. Найдём количество моль водорода:
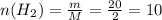 моль
моль
2. Рассмотрим соотношение кислорода и водорода. Исходя из отношения, вычисляем количество моль кислорода:
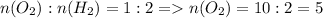 моль
моль
3. Находим объём кислорода:
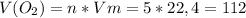 л
л
ответ: 112л
2) 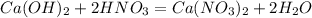
1. Находим количество моль гидроксила кальция:
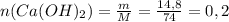 моль
моль
2. Рассмотри соотношение воды и гидроксида кальция. Исходя из этого отношения, можно узнать количество моль воды:
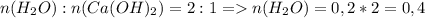 моль
моль
3. Зная количество моль воды, можно найти массу воды:
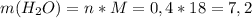 г
г
ответ: 7,2г
АЛЮМИНИЙ (лат. Aluminium), Al (читается «алюминий») , химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3 s 2 p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III).
Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
МЕДЬ (лат. Cuprum), Cu (читается «купрум») , химический элемент с атомным номером 29, атомная масса 63,546. Латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
Природная медь состоит из двух стабильных нуклидов 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3 s 2 p 6 d 10 4s 1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро и золото.
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ — от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726, 20,291, 36,8, 58,9 и 82,7 эВ. Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В. В ряду стандартных потенциалов медь расположена правее водорода и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь — красивый розовато-красный пластичный металл.
1)2H2+O2=2H2O пропорция 20г -- Х
4 -- 22,4 Х=20*22,4/4=112 необходимо 112л О2
2)Ca(OH)2+2HNO3 = Ca(NO3)2 + 2H2O пропорция 14,8 --Х
74 -- 36 Х=14,8*36/74=7,2г
образуется 7,2г воды