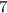 Li
Li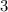
Объяснение:
Выбери верные утверждения.
-атом в низшей степени окисления может быть только восстановителем (1)
-атомы неметаллов могут быть окислителями (2)
-число электронов, присоединённых окислителем, всегда больше числа электронов, отданных восстановителем (3)
-в ходе реакции атомы окислителя теряют электроны
восстановитель в ходе реакции принимает электроны(4)
Верные утверждения: только 1.
Атомы неметаллов могут быть как окислителями, так и восстановителями, например в реакции: 2Н2+О2 = Н2О - водород - восстановитель, в реакции Н2 + 2Na = 2NaH - водород -
окислитель.
Число электронов, присоединённых окислителем, всегда равно числу электронов, отданных восстановителем. На этом основан электронный баланс.
В ходе реакции атомы окислителя принимают электроны и при этом восстанавливаются, а атомы восстановителя в ходе реакции отдают электроны и при этом окисляются.
Объяснение:
Смесь кальция и железа массой 130г. обработали избытком воды. При этом объем выделившегося газа составил 30,8дм3. Определите массовые доли компонентов смеси.
Ясно, что в этих условиях с водой будет реагировать только кальций:
30,8дм³
Са + 2Н2О = Ca(OH)2 + H2↑
30,8дм³ : 22,4 дм³/моль = 1,375 моль
Ясно, что газ это водород количеством 1,375 моль
Найдем массу кальция, поскольку количество кальция тоже 1,375 моль.
m(Ca) 40 г/моль × 1,375 моль = 55 г
По условию задачи масса смеси 130 г. Вычислим тогда массу железа: 130 г - 55 г = 75 г
ω(Са) = 55 : 130 = 0,423 или 42,3%
ω(Fe) =75 : 130 = 0,577 или 57,7%
литий и натрий уже повторяются.