Вопрос 1
Находим массу 1 моля SO₂:
М(SO₂) = 32 + 2*16 = 64 г/моль
Находим количество молей SO₂:
n(SO₂) = 3,2/64 = 0,05 моль
Так как 1 моль любого газа при н.у. занимает объём 22,4 л, то 0,05 моль имеют объём:
0,05*22,4 = 1,12 л
Вопрос 2
Уравнение Менделеева-Клапейрона:
Р*V = n*R*T
где: Р - давление газа , Па. Р = 90 кПа = 90000 Па
V - объем газа, м³
n - количество молей газа, n = 0,05
R - универсальная газовая постоянная, R = 8,314 Дж/(моль*К)
T - температура, °К. T = 30 + 273 = 303°К
Отсюда объём газа при данных условиях равен:
V = n*R*T/Р = 0,05*8,314*303/90000 = 0,0014 м³ = 1,4 л
Вопрос 3
Относительную плотность газа по воздуху вычисляют по формуле:
D = M(SO₂)/М(возд)
где: M(SO₂) и М(возд) - соответственно молекулярные массы M SO₂ и воздуха. М(возд) = 29
D = 64/29 = 2,207
Вопрос 4
Количество молекул в 1 моле любого вещества равно 6,02*10²³. Соответственно в 0,05 моль количество молекул равно:
0,05 * 6,02*10²³ = 3*10²² молекул
Задача: Определите молекулярную формулу углеводорода, если при сжигании его количеством вещества 0,1 моль образуется вода массой 5,4 г и углекислый газ объемом 8,96 л (н.у.).
Дано:
n (CxHy) = 0,1 моль ;
m (H₂O) = 5,4 г ;
V (CO₂) = 8,96 л.
Найти:
x, y (формулу) — ?
1. Вычислим количество вещества воды и углекислого газа по формулам: n = m : M и n = V : Vm; где: n - количество вещества (моль), m - масса (г), M - молярная масса из таблицы (г/моль), V - объём (л), Vm - молярный объём газов, постоянная величина, равная 22,4 (л/моль) при н.у.
n (H₂O) = 5,4 г : 18 г/моль = 0,3 (моль).
n (CO₂) = 8,96 л : 22,4 л/моль = 0,4 (моль).
2. Используя правило, найдём массы углерода и водорода в углеводороде.
n (C) = n (CO₂) ; n (H) = 2n (H₂O), соответственно ⇒
n (C) = 0,4 (моль); n (H) = 0,3 · 2 = 0,6 (моль).
Из вышеописанной формулы (n = m : M) выразим массу и найдём её для каждого элемента в соединении.
m (C) = 0,4 моль · 12 г/моль = 4,8 (г).
m (H) = 0,6 моль · 1 г/моль = 0,6 (г).
Тогда, m (CxHy) = 4,8 + 0,6 = 5,4 (г).
3. Мы нашли массу углеводорода, а также нам в условии дано его количество вещества. По вышеописанной формуле (n = m : M) выразим молярную массу и найдём её.
M (CxHy) = 5,4 г : 0,1 моль = 54 (г/моль).
4. Но нам это ничего не даёт, поэтому нам нужно найти мольное соотношение углерода и водорода.
C : H = 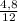 :
: 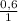 = 0,4 : 0,6 = 4 : 6 = 2 : 3.
= 0,4 : 0,6 = 4 : 6 = 2 : 3.
Итак, простейшая формула: C₂H₃. Но её молярная масса = 27 г/моль, а нам нужно 54 г/моль.
Из этого следует, что истинная формула: C₄H₆.
ответ: C₄H₆.
1) Cu+2AgNO3---> Cu(NO3)2+2Ag
2) 2Al + 3H2SO4---> Al2(SO4)3+3H2
вроде эт не ионные, а окислительно-восстановительные реакции!
2.
NaOH+HNO3>NaNO3+H2O
v(NaOH)=m(NaOH)/M(NaOH)=4г / 40г/моль =0,1 моль
v(NaOH)=v(NaNO3)
m(NaNO3)=v(NaNO3)*M(NaNO3)=0,1 моль * 85г/моль =8,5 г.
ответ:8,5 г.