1. При комнатной температуре кислород реагирует со всеми металлами.
Неверно
2. Кислород окисляет щелочноземельные металлы при обычных условиях.
Верно
3. В лаборатории кислород можно получить из вещества, формула которого:
KMnO4
4. В результате разложения воды не образуется(-ются):
H2O
K2O2
5. Для химического элемента или простого вещества кислорода неверно утверждение:
В реакциях с неметаллами проявляет восстановительные свойства.
6. Кислород отличается от озона:
Физическими свойствам и.
7. Выбери характеристику озона:
Образуется в воздухе во время грозы .
8. Только при нагревании кислород реагирует с:
Mg - С магнием.
 -реакция разложения(из одного вещества образуется два продукта),эндотермическая(требуется нагревание,т.е. энергия из вне)
-реакция разложения(из одного вещества образуется два продукта),эндотермическая(требуется нагревание,т.е. энергия из вне)
720 000 г х л

32 г 22,4 л
1. Так как техническая сера содержит 10% примесей,значит массовая доля ее в образце - 90%:
800 кг - 100%, а
у кг____90, откуда х=800*90/100=720 кг
2. Переведя кг в граммы и подставив массу в уравнение реакции,получим:
при взаимодействии 32 г серы образуется 22,4 л оксида,а
при -- // -- 720000 г____________х л, откуда х=720000*22,4/32=504000 л или 504 м в кубе

0 0 +3 -1

0 +3
Cr - 3e = Cr |2|восстановитель(окисление)
0 -1
Cl_2 + 2e = 2Cl |3|окислитель(восстановление)
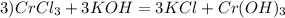
Дано:
ρ (р - ра NaOH) = 1,22 г\ см^3
w (р- ра NaOH) = 20%
m(C6H6) = 46,8 г
Найти:
V(р-ра NaOH)
Вычислим объем образовавшегося газа после бромирования бензола:
46,8 г х л
C6H6 + Br2 = C6H5Br + HBr↑
78 г 22,4 л
46,8 г -- х л
78 г -- 22,4 л
х = 46,8 г ∙ 22,4 л \ 78 г = 13,44 л
Вычислим массу гидроксида натрия, который необходим на нейтрализацию:
x г 13,44 л
NaOH + HBr = NaBr + H2O
40 г 22,4 л
x г -- 13,44 л
40 г -- 22,4 л
х = 40 г ∙ 13,44 л \ 22,4 л = 24 г
Вычислим массу и объем раствора NaOH:
m(р-ра) = m(р.в.) ∙100%\ w(р-ра)
m(р-ра NaOH) = 24 г ∙100%\ 20% = 120 г
V(р-ра NaOH) = m (р-ра NaOH) \ ρ(р-ра NaOH)
V(р-ра NaOH) = 120 г\ 1,22 г\ см^3 = 98,36 см^3 = 98,36 мл
ответ: V(р-ра NaOH) = 98,36 мл