Объяснение:
Задание 4
Cu(OH)2(tC)-->CuO+H2O
CuO+2HNO3-->Cu(NO3)2 + H2O
Задание 5
SO3 + H2O -> H2SO4
H2SO4 + 2KOH-> K2SO4 + 2H2O
K2SO4 + Ba(OH)2 -> BaSO4 + 2KOH
2KOH+CuCl2->2KCl+Cu(OH)2
Задание 6
4P+5O2=2P2O5
P2O5+3H2O=2H3PO4
H3PO4 + 3KOH = K3PO4 + 3H2O
Задание 7
K2O + H2O = 2KOH
Al2(SO4)3 + 6KOH = 2Al(OH)3 + 3K2SO4
CuCl2 + 2 KOH → Cu(OH)2 + 2 KCl
FeCl 3 + 3 KOH → Fe(OH) 3 + 3 KCl
1) CuO+H2SO4=CuSO4+H2O
2) CuO+HNO3разб=Cu(NO3)2+H2O
3) Cu(NO3)2+2NaOH=Cu(OH)2+2NaNO3
4) CuSO4+2NaOH=Cu(OH)2+Na2SO4
5) Cu(OH)2 (t=200C) =CuO+H2O
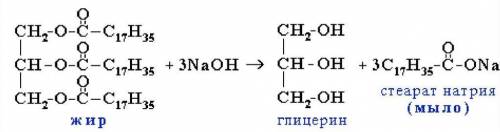
Дано:
m(р-ра NaOH) = 50 гр
ω(NaOH) = 10%
Найти:
m(C₁₇H₃₅-COONa) - ?
1) Для начала мы напишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться. Уравнение этой реакций представлен внизу↓.
2) Далее находим массу чистого вещества у гидроксида натрия, а потом его количества вещества, и потом количества вещества у образовавшейся соли по уравнению реакций:
m(NaOH) = (m(р-ра NaOH)×ω(NaOH))/100% = (50 гр × 10%)/100% = 50 гр × 0,1 = 5 гр
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 5 гр / 40 гр/моль = 0,125 моль
n(NaOH) : n(C₁₇H₃₅-COONa) = 3 : 3 = 1 : 1 ⇒ n(C₁₇H₃₅-COONa) = n(NaOH) = 0,125 моль - по уравнению реакций
3) Теперь находим массу образовавшейся соли:
M(C₁₇H₃₅-COONa) = 12×18 + 1×35 + 16×2 + 23 = 216 + 35 + 32 + 23 = 306 гр/моль
m(C₁₇H₃₅-COONa) = n(C₁₇H₃₅-COONa)×M(C₁₇H₃₅-COONa) = 0,125 моль × 306 гр/моль = 38,25 гр
ответ: m(C₁₇H₃₅-COONa) = 38,25 гр
Решено от : 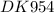
41.84 гр
Объяснение:
Допустим у нас есть 100гр раствора с массой долей 29.5%. В 100гр раствора содержится 29.5 соли. Находим массу воды в 100 но раствора
1) 100 - 29.5 = 70.5 гр воды.
Это значит что 29.5 гр соли растворили в 70.5 гр воды. Находим массу соли которая растворится в 100 гр воды (то есть растворимость).
2) 29.5 гр соли . 70.5гр воды
Х гр соли 100гр воды.
Х = 29.5. *100/70.5= 41.84 гр