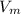 * n = 22,4 м³/кмоль * 3,5 кмоль = 78,4 м³
* n = 22,4 м³/кмоль * 3,5 кмоль = 78,4 м³1)Находим массу чистого вещества(без примесей)
500 000 г-100%
хг -30%
х=500 000 * 30%/100%= 150 000 г (это масса примесей)
m(чистого в-ва)=500 000 - 150 000= 350 000 г
2) Уравнение реакции:
350 000 г х л
CaCO3 + 2HCl> CaCl2 + CO2(стрелка вверх) +H2O
M=100г/моль Vm= 22,4л/моль
m=100 г V=22,4л
Пропорция: 350 000/100=x/22,4
=> x=350 000*22,4/100= 78 400 л
3)Рассчитаем кол-во вещества газа:
Формула: v=V/Vm
v(CO2)=78 400 л/22,4 л/моль= 3500 молей.
Овет:78 400 л; 3 500 молей.
Дано:
m раствора (H2SO4) = 490 г
ω(H2SO4) = 10 %
V(H2S) = ?
FeS + H2SO4 = H2S + FeSO4
m(H2SO4) = 490 * 0,1 = 49 г
ν(H2SO4) = 49/98 = 0,5 моль
По уравнению реакции:
ν(H2SO4) = ν(H2S) = 0,5 моль
V(H2S) = 0,5 * 22,4 = 11,2 л