Объяснение:
вычислить молярную концентрацию и титр раствора соляной кислоты, если на титрование 0,2305 г тетробората натрия потребовалось 8,30 мл раствора кислоты
Дана масса тетрабората натрия Na2B4O7, Молярная масса тетрабората натрия 201, 2 г/моль.
Взаимодействие тетрабората натрия с соляной кислотой протекает по уравнению:
Na2B4O7 + 2HCl + 5H2O = 2H3BO3 + 2NaCl
По уравнению 1 моль тетрабората натрия реагирует с 2 моль HCl
отсюда Мэк Na2B4O7 равен М(Na2B4O7) : 2 или 201,2 г/моль : 2 =
100,6 г/моль - это молярная масса эквивалента
Найдем число моль-экв в навеске тетрабората натрия 0,2305 г
n ( Na2B4O7) = 0,2305 г : 100,6 г-экв/моль = 0,00229 моль-экв
Молярная масса HCl равна 36,5 г/моль
Найдем массу НСl соответствующую моль-экв тетрабората натрия
36,5 г/моль х 0,00229 моль = 0,0 8358 г эта масса кислоты находится в 8,30 мл раствора НСl
Вычислим массу соляной кислоты в 1 литре раствора
0,08358 г 8,30 мл
х г 1000 мл
х= (0,08358 г х 1000)/ 8,3 = 10,07 г
Если теперь массу соляной кислоты в 1 л раствора разделить
на молярную массу кислоты мы получим молярную концентрацию
10,07 г : 36,5 = 0,276 моль/л или поскольку соляная кислота одноосновная 0,276 моль-экв/л
Титр показывает массу кислоты в 1 мл раствора
10,07 г : 1000 мл = 0,01 г/мл
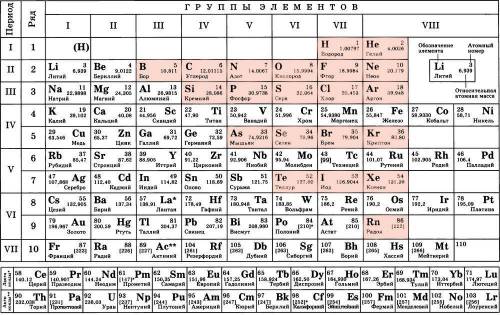
Для начала укажем место расположения атомов-неметаллов в ПСХЭ Д.И. Менделеева.
Начиная с третьей группы главной подгруппы, каждая группа "дарит" нам один элемент-неметалл.
В третей группе главной подгруппы неметалл - бор.
В четвёртой группе главной подгруппы неметаллы - углерод, кремний.
В пятой группе главной подгруппы неметаллы - азот, фосфор, мышьяк.
В шестой группе главной подгруппы неметаллы - кислород, сера, селен, теллур.
В седьмой группе главной подгруппы неметаллы - водород (но иногда его ставят и первую группу главную подгруппу, так как он строением похож на щелочные металлы : также имеет на своём внешнем энергетическом уровне один валентный электрон), фтор, хлор, бром, иод (астат является радиоактивным металлом).
В восьмой группе главной подгруппы неметаллы - это все инертные газы : гелий, неон, аргон, криптон, ксенон, радон.
(Хочу отметить, что есть и другие поиска элементов-неметаллов в ПСХЭ : например, проведение диагонали от нижнего правого края бора до нижнего левого края астата).
Итак, что объединяет выше перечисленные неметаллы?
Если мы вспомним правило : "Количество валентных электронов химического элемента, который находится в главной подгруппе, равно номеру его группы", то мы поймём, что большинство неметаллов имеет больше трёх (за исключением бора и гелия) электронов на своём внешнем энергетическом уровне.
Это также является их отличительной особенностью от элементов-металлов! Потому что большинство элементов-металлов имеют от одного до трёх электронов на своём внешнем слое. То есть, им проще отдать электроны, нежели их присоединить (отсюда металлы и являются восстановителями в химических реакциях).
4P + 5O2 → 2P2O5
H3PO4 + P2O5 → 3HPO3
HPO3 + 2HNO3 → H3PO4 + N2O5
6K + 2H3PO4 → 2K3PO4 + 3H2
3Ca(NO3)2 + 2K3PO4 → Ca3(PO4)2 + 6KNO3
Объяснение: