Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов. Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
1
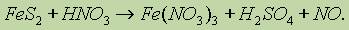
а)2NaCl+K2SO4=2KCl+Na2SO4 р.обмена заряды сам сможешь раставить,где в середеине вечества большие цифры это ИНДЕКСЫ на письме их маленькими нужно писать!
2Na+2Cl+2K+SO4=2K+2Cl+2Na+SO4 ВСЕ СОКРАЩАЕТСЯ РЕАКЦИЯ ИДЕТ
б)Fe(CL)3+3KOH=Fe(OH)3+3KCL р.обмена
Fe+3Cl+3K+3OH=Fe(OH)3 образует осадок не расписываем+3K+3Cl Сократишь,должно остаться Fe+3OH=Fe(OH)3
в)Zn(OH)2+H2SO4=ZnSO4+2H2O р обмена
Zn(OH)2 осадок+2H+SO4=Zn+So4+4H+2O сократишь,вроде так