Растворы галогеноводородов в воде являются кислотами: это HF — фтороводородная, или плавиковая кислота, HCl — хлороводородная, или соляная кислота, HBr — бромоводородная кислота, HI — иодоводородная кислота их к электролитической диссоциации с образованием катионов водорода растет от HF к HI.
Самая сильная из галогеноводородных кислот — иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи H—F (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и расстояние H—F, прочность молекул уменьшается и, соответственно к электролитической диссоциации увеличивается.Элементы главной подгруппы VII группы периодической системы, объединенные под общим названием галогены, фтор (F), хлор (Cl), бром (Br), иод (I), астат (At) (редко встречающийся в природе) — типичные неметаллы. Это и понятно, ведь их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли. Отсюда общее название «галогены», т. е. «рождающие соли».
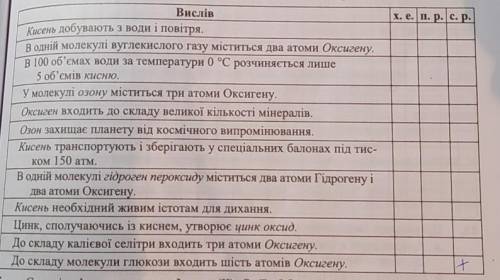
2) хе
3)пр
4)пр
5)хе
6)пр
7) пр
8) ск
9) пр
10) ск
11)хе
12)хе