Решение выглядит так:
СH2NH2-CH2-CH2-CH2-CHNH2-COOH+HOC3H7=CH2NH2-CH2-CH2-CH2-CHNH2-COOC3H7+H2O
1.
Очевидно, что Б - кислота.
Но какая - пока не могу сказать. Если бы в условии не было сказано, что раствор этот не имеет запаха, я мог бы утверждать, что Б - это соляная кислота.
При реакции соляной кислоты с перманганатом калия выделяется хлор.
Возможно, это был хлорид? Не знаю, не знаю.. Пока ещё думаю...
Вещество А - это карбонат/гидрокарбонат. Катион, скорее всего, является ионом щелочного металла.
"Почему покраснел и посинел черничный сок ???Чем его можно заменить?"
Этот сок можно отнести к кислотно-основным индикаторам.
Заменить можно лакмусом, к примеру.
2.
S + O2 --> SO2
SO2 + H2O --> H2SO3
H2SO3 + 2KOH --> K2SO3 + 2H2O
K2SO3 --t--> K2O + SO2
K2O + H2O --> 2KOH
2KOH + Cu(NO3)2 -- 2KNO3 + Cu(OH)2
Дано:
m(раствора NaOH=80г
ω%(NaCI)=8%
------------------------------------
m(осадка)-?
1. Определим массу гидроксида натрия в 80г. 8% раствора:
m(NaOH)=ω%(NaOH)×m(раствора NaOH)÷100%
m(NaOH)=8%×80г.÷100%=6,4г.
2. Определим молярную массу гидроксида натрия:
M(NaOH)=23+16+1=40г./моль
3. Определим количество вещества гидроксида натрия в 6,4г.:
n(NaOH)=6,4г.÷40г./моль=0,16моль
4. Запишем уравнение реакции:
3NaOH + Fe(NO₃)₃ = 3NaNO₃ + Fe(OH)₃↓
по уравнению реакции из 3моль гидроксида натрия образуется 1 моль гидроксида железа(lll);
по условию задачи гидроксида натрия 0,16моль, значит образуется в три раза меньше моль гидроксида железа(lll)
n[Fe(OH)₃]=0,16моль÷3мольх1моль=0,05моль
5. Определим молярную массу гидроксида железа(lll):
M[Fe(OH)₃]=56+(16+1)×3=107г./моль
6. Определим массу гидроксида железа(lll) количеством вещества 0,05моль:
m[Fe(OH)₃]=n[Fe(OH)₃]×M[Fe(OH)₃]
m[Fe(OH)₃]=0,05моль×107г./моль=5,35г.
7. ответ: масса осадка гидроксида железа(lll) 5,35г.
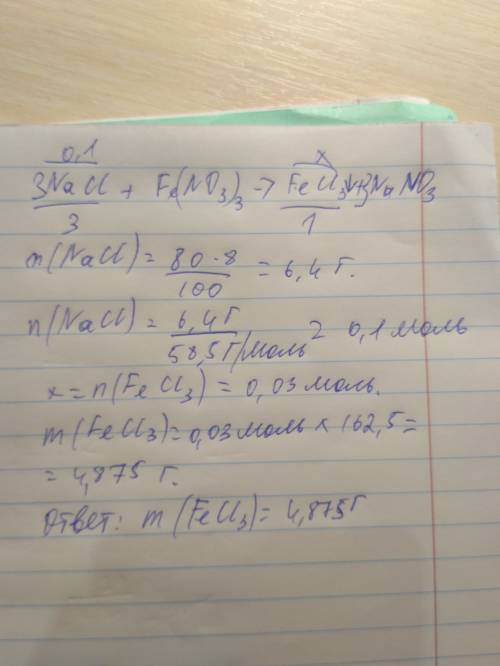
Структурная формула лизина:
СH2NH2-CH2-CH2-CH2-CHNH2-COOH + HOC3H7>CH2NH2-CH2-CH2-CH2-CHNH2-COOC3H7+H2O