1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
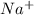

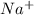
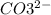

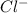
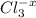


Объяснение:
1. Даны растворы веществ: хлорид натрия, карбонат натрия, сульфат натрия. Используя качественные реакции на анионы определите наличие этих анионов в веществах. Составьте схему, реакции М, И, и СИ.
Раствор хлорида натрия, В растворе присутствуют анионы Сl (-)
Реактивом на хлорид-ионы служит раствор нитрата серебра.
NaCl + AgNO3 = AgCl ↓ + NaNO3
Na (+) + Cl(-) + Ag(+) + NO3(-) = AgCl ↓ + Na (+) + NO3(-)
Ag(+) + Cl(-) = AgCl ↓
Аналитическим сигналом служит появление белого рыхлого творожистого осадка AgCl, который быстро темнеет на свету
Раствор карбоната натрия содержит в своем составе карбонат ионы СО3(2-)
Реактивом на карбонат- ионы служит раствор любой крепкой кислоты, содержащей в растворе ионы Н(+)
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
2 Na+) + CO3(2-) + 2H(+) + 2Cl(-) = 2Na(+) + 2Cl(-) + H2O + CO2↑
CO3(2-) + 2H(+) = H2O + CO2↑
Аналитическим сигналом является вскипание раствора и шипение углекислого газа
В растворе сульфата натрия содержаться сульфат- ионы
Реактивом на сульфат ионы служит любая растворимая соль бария (обычно ВаCl2).
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2 Na+) + SO4(2-) + Ba(2+) + 2Cl(-) = 2Na(+) + 2Cl(-) + BaSO4↓
SO4(2-) + Ba(2+) = BaSO4↓
Aналитическим сигналом служит выпадение белого мелко кристаллического осадка не растворимого в растворах кислот и щелочей.
Задача 2. Получите угольную кислоту и докажите ее свойства.
В промышленности угольную кислоту приготовляют растворением под давлением углекислого газа в воде.
СО2 + Н2О ⇆ Н2СО3
В лаборатории можно получить угольную кислоту добавив к раствору гидрокарбоната натрия небольшое количество лимонной кислоты. Так ранее готовили содовую воду в ресторанах.
Доказать свойство угольной кислоты не сложно
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор - лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3↓ + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень непрочная кислота – разлагается не только при нагревании, но и при стоянии в открытой посуде
Н2СО3 --> H2O + CO2↑
Оформить как практическую работу.
по условию пол-м равенство (30.1*10^23*x+18.06*10^23*y)*5 = 60.2*10^23*x+ 132.44*10^23*y, откуда х = 1 моль, а у = 2.143 моль;
т.о. объемная доля метана (1/(1+2.143))*100 = 31.82%, объемная доля CO2 соот-но (2.143/(1+2.143))*100 = 68.18%.