Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами - эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
Растворы кислот изменяют цвет индикаторов: лакмуса - в красный, метилового оранжевого - в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. Рассматривая это свойство неорганических и органических кислот, подчеркнем, что взаимодействие HNO 3 и Н 2 SO 4 (конц.) с металлами протекает иначе, но эти особенности указанных кислот будут объяснены несколько позднее.
Объяснение:
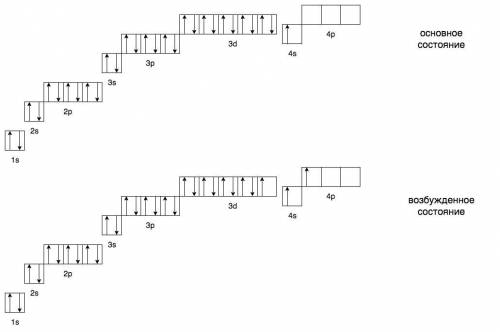
№29 - Cu
Порядковый номер в таблице Менделеева - 29 => общее кол-во электронов = 29
Расположен в 4-ом периоде => число энергетических уровней = 4
Расположен во 1-ой группе, побочной подгруппе
d-элемент
Электронная конфигурация: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰
На 4s только один электрон (проскок электрона), т.к. энергетически более выгодно иметь 5 или 10 электронов на d-подуровне.
При возбуждении этот электрон переходит обратно на 4s, а с него на 4p.
В основном состоянии: 28 спаренных и 1 неспаренный.
В возбужденном состоянии: 26 спаренных и 3 неспаренных.
Объяснение:
ответ: Ba-BaO-BaCl2-BaSO4
Объяснение: проверь здесь опечатка( BaCl2-CaSo4)
1)2Ba+O2=2BaO
2)BaO+2HCI=BaCl2+H2O
3)BaCl2+ H2SO4=BaSO4↓+2HCI
Это цепочки превращений,обрати внимание, во всех формулах стоит барий, поэтому получить CaSo4, мы не можем.