0,88 г 4,32 г
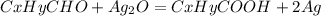
х г 216 г
1. Сначала найдем чистую массу альдегида в растворе:
m(CxHy)=w(CxHy)*m(раствора)=0,22*4=0,88 г
2. Подставив в уравнение эту массу получим относительную молекулярную массу вещества:
при взаимодействии 0,88 г альдегида выпадает 4,32 г осадка, а
при -- // -- // -- х г______________________216 г, откуда
х=0,88*216/4,32=44 г
3. Теперь подставив в формулу определения относительной массы,получим уравнение:
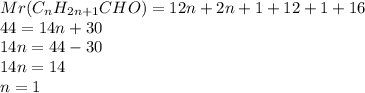
Значит формула альдегида: 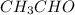 -уксусный альдегид
-уксусный альдегид
n(NH3)=11.2/22.4=0.5 моль
Вещества реагируют в соотношении 1:1, поэтому 0,5 моль HNO3 останется после р-ии. И получится 0,5 моль NH4NO3