1. Определите ряд элементов, которые имеют три внешних электронов. А) Si, P, S B) B, Ga In C) Br,СI, F D) Cu, Fe, F [1] 2. Укажите вид ковалентной связи в молекулах: HBr, РH3, F2 CO2, CH4, О2, SiO2, НCl, H2.
К какому элементу в вышеуказанных соединениях сдвинута общая электронная пара? [1]
3. Определите степень окисления атомов элементов в следующих соединениях
CaO, HI, Fe2Cl3, MnO4, SO2 [1]
4. Какое из веществ является растворимым: А) BaSO4 B) Ag2CO3 C) Zn(NO3)2 D) Сu(ОН)2
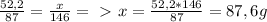 , из этого следует, что HCl дан в избытке. Расчет Cl₂ введем по MnO₂. По такому же принципу составим пропорцию:
, из этого следует, что HCl дан в избытке. Расчет Cl₂ введем по MnO₂. По такому же принципу составим пропорцию: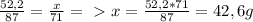
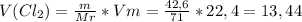
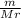 )
)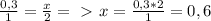
Химические вещества могут быть простыми и сложными. Среди простых веществ выделяют металлы и неметаллы.
Сложные неорганические соединения делят на три основных
класса — оксиды, гидроксиды и соли.
Оксиды — соединения элементов с кислородом.
Если элементы проявляют переменную степень окисления,
то образуют оксиды различного состава, что учитывают в названии оксида: Al2
O3 — оксид алюминия; N2
O3 — оксид азота (III).
Оксиды делят на несолеобразующие и солеобразующие.
Несолеобразующие оксиды весьма немногочисленны, например, CO, NO, N2
O. Среди солеобразующих оксидов в соответствии с химическими свойствами выделяют основные, кислотные и амфотерные.
Основные оксиды образуют только типичные металлы
в степени окисления +1, +2 (не всегда).
Кислотные оксиды образуют неметаллы, а также металлы
в высоких степенях окисления (+6, +7). Оксиды неметаллов —
SO2
, P2
O5
, оксиды металлов — CrO
+6
3 , Mn O +7
2 7 .
Амфотерные оксиды образуют металлы в степени окисления
+3, +4, +5, иногда +2. Амфотерные оксиды некоторых металлов в степени окисления +2 — ZnO, PbO, SnO, BeO — следует