1 ( ). Аллотропными видоизменениями являются:
Б. Озон и кислород.
2 ( ). Характеристика реакции, уравнение которой
H2S04 + 2NaOH = Na2S04 + 2Н20:
B. Обмена, не ОВР, необратимая.
( ). Сокращенное ионное уравнение
Ва2+ + SOf- = BaS04
отображает взаимодействие серной кислоты и вещества:
В. Нитрата бария.
( ). Характеристика реакции, уравнение которой
. Б. Изомеризации, гомогенная, каталитическая.
( ). При повышении температуры на 30 °С (температурный коэффициент равен 3) скорость реакции увеличивается:
Г. В 27 раз.
( ). Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой
2SO2 + 02 < * 2S03 + Q,
в сторону образования продуктов реакции:
B. Понижение температуры и повышение давления.
7 ( ). Окраска лакмуса в растворе хлорида цинка:
Б. Красная.
8 ( ). Вещество, не подвергающееся гидролизу:
А. Этилен.
9 ( ). Окислитель в реакции синтеза аммиака из азота и водорода:
А. N
10 ( ). Масса угля, который необходимо сжечь для получения 201 кДж теплоты, в соответствии с термохимическим уравнением
С + 02 = С02 + 402 кДж
равна:
А. 6 г.
ЧАСТЬ Б. Задания со свободным ответом
11 ( ). Расставьте коэффициенты в уравнении реакции, схема которой
4Fe + 6Н20 + .3O2.. ->4 Fe(OH)3.
окислитель O2 восстановитель.Fe
12 ( ). Составьте молекулярные уравнения реакций, соответствующие сокращенным ионным:
а) NH+ + ОН" = NH3 + Н20;
NH4Cl + NaOH = NaCl + NH3 + H2O
б) А13+ + ЗОН- = А1(ОН)3.
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
13 ( ). Напишите уравнения реакций, с которых можно осуществить следующие превращения:
Дано:
n(Zn) = 0,2 моль
Найти:
m(Zn) - ?
n = 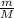 ⇒ m = n * M
⇒ m = n * M
M(Zn) = Ar(Zn) = 65 г/моль
m(Zn) = 0,2 моль * 65 г/моль = 13 г.
ответ: m(Zn) = 13 г.2)Дано:
N(MgO) = 3 * 10²³ частиц
Найти:
m(MgO) - ?
n(MgO) - ?
n(MgO) =  =
=  ≈ 0,5 моль
≈ 0,5 моль
m(MgO) = n * M
M(MgO) = Ar(Mg) + Ar(O) = 24 * 16 = 40 г/моль
m(MgO) = 0,5 моль * 40 г/моль = 20 г.
ответ: n(MgO) ≈ 0,5 моль, m(MgO) = 20 г.3)Дано:
m(CO₂) = 22 г.
Найти:
n(CO₂) - ?
N(CO₂) - ?
n(CO₂) = 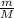
M(CO₂) = Ar(C) + Ar(O) * 2 = 12 + 16 * 2 = 12 + 32 = 44 г/моль
n(CO₂) = 22 г. / 44 г/моль = 0,5 моль
N(CO₂) = n * N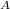 = 0,5 моль * 6,02 * 10²³ моль⁻¹ = 3,01 * 10²³ частиц
= 0,5 моль * 6,02 * 10²³ моль⁻¹ = 3,01 * 10²³ частиц
Дано:
N(Br₂) = 12 * 10²³ частиц
Найти:
m(Br₂) - ?
n(Br₂) - ?
n(Br₂) =  =
= 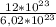 ≈ 2 моль
≈ 2 моль
m(Br₂) = n * M
M(Br₂) = Ar(Br) * 2 = 80 * 2 = 160 г/моль
m(Br₂) = 2 * 160 = 320 г.
ответ: n(Br₂) = 2 моль, m(Br₂) = 320 г.5)Дано:
m(H₂SO₄) = 98 г.
Найти:
N(H₂SO₄) - ?
n(H₂SO₄) - ?
n(H₂SO₄) = 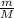
M(H₂SO₄) = Ar(H) * 2 + Ar(S) + Ar(O) * 4 = 1 * 2 + 32 + 16 * 2 = 2 + 32 + 32 =
68 г/моль
n(H₂SO₄) = 98 г. / 68 г/моль ≈ 1,5 моль
N(H₂SO₄) = n * N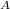 = 1.5 моль * 6,02 * 10²³ моль⁻¹ = 9,03 частиц
= 1.5 моль * 6,02 * 10²³ моль⁻¹ = 9,03 частиц
Объяснение:
При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
Решение. С натрием реагируют и этанол, и фенол:
2С2Н5ОН + 2Na → 2C2H5ONa + Н2↑,
2С6Н5ОН + 2Na → 2C6H5ONa + Н2↑,
а с гидроксидом калия -только фенол:
С6Н5ОН + KОН → С6Н5ОK + Н2О.
v(KOH) = 25-1,4-0,4 / 56 = 0,25 моль = v(C6H5OH).
Из 0,25 моль фенола в реакции с натрием выделилось 0,25/2 = 0,125 моль Н2, а всего выделилось 6,72/22,4 = 0,3 моль Н2. Оставшиеся 0,3-0,125 = 0,175 моль Н2 выделились из этанола, которого израсходовано 0,175-2 = 0,35 моль.
Массы веществ в исходной смеси: m(С6Н5ОН) = 0,25-94 = 23,5 г, m(С2Н5ОН) = 0,35-46 = 16,1 г. Массовые доли: (С6Н5ОН) = 23,5 / (23,5+16,1) = 0,593, или 59,3%, (С2Н5ОН)= 16,1 /(23,5+16,1) = 0,407, или 40,7%.
ответ. 59,3% фенола, 40,7% этанола.