
 + 3Cl(2)
+ 3Cl(2) = 2Fe
= 2Fe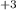 Cl(3)
Cl(3)
 - 3e = Fe
- 3e = Fe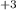 восстановитель 2
восстановитель 2  +2e = 2Cl
+2e = 2Cl окислитель 3
окислитель 3  +2e = 2Cl
+2e = 2Cl . Сумма ат. Cl c лев. и пр. сторон равны, кол-во ат. Fe тоже равны до и после р.
. Сумма ат. Cl c лев. и пр. сторон равны, кол-во ат. Fe тоже равны до и после р. +5Cl(2)
+5Cl(2) =2P
=2P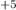 Cl(5)
Cl(5)
 - 5e = P
- 5e = P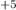 восстановит. 2
восстановит. 2 + 2e = 2Cl
+ 2e = 2Cl окислит. 5
окислит. 5 + 2H(2)
+ 2H(2)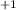 O
O = 4H
= 4H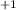 Cl
Cl + O(2)
+ O(2)
 +2e = 2Cl
+2e = 2Cl окислит. 2
окислит. 2 - 4e = O(2)
- 4e = O(2) восстановит. 1
восстановит. 1 +2e = 2Cl
+2e = 2Cl перед Cl мы поставили 2 для уравнения ат. Cl c правой стороны, 2 * 2 = 4
перед Cl мы поставили 2 для уравнения ат. Cl c правой стороны, 2 * 2 = 4 +2NaOH=NaCl
+2NaOH=NaCl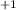 O+NaCl
O+NaCl +H(2)O
+H(2)O +1e = Сl
+1e = Сl 1 окислит.
1 окислит.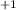 1 восстан.
1 восстан. +6NaOH=NaCl
+6NaOH=NaCl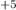 O(3)+5NaCl
O(3)+5NaCl +3H(2)O
+3H(2)O +1e = Сl
+1e = Сl 5 окислит.
5 окислит.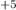 1 восстан.
1 восстан.
На счёт последней реакции не знаю...
Объяснение: