1) Электролиз:
2NaBr = 2Na + Br2.
2) Это гальванический элемент Даниэля:
Две разделенные перегородкой емкости. В одной цинковый электрод, погруженный в раствор сульфата цинка, в другой - медный электрод, погруженный в раствор сульфата меди. При замыкании цепи образуется эл. ток вызванный эдс, равной примерно разности стандартных электродных потенциалов меди и цинка. (При условии примерно равной концентрации растворов сульфатов меди и цинка).
Е = Е(Cu) - E(Zn) = 0,337 - (-0,763) = 1,1 В.
Формула окислительно-восстановительной реакции:
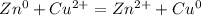
3) Уравнения гидролиза CH3COOK:
В молекулярной форме:
CH3COOK + H2O = CH3COOH + KOH.
В полной йонной форме:
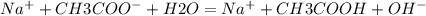
В сокращенной ионной форме:

Слабая кислота и сильное основание дают щелочную реакцию с pH>7.
4) По определению молярности раствора:
0,2 = m/(M*V), где m - искомая масса соли, M = M(NaNO3) = 85 г/моль,
V = 400 мл = 0,4 л.
m = 0,2*0,4*85 = 6,8 г
ответ: 6,8 г.
5) 4H2O2 + 4KMnO4 = 4MnO2 + 4KOH + 5O2 + 2H20
Перманганат(MnO4^(-1)) выступает в роли окислителя, а конкретно - марганец. Он принимает 3 электрона и степень окисления становится (+4)
Mn(+7) + 3e = Mn(+4)
Еще в роли окислителя выступают два иона ОН в перекиси водорода:
2ОН(0) + 2е = 2ОН(-1)
Кислород восстановитель
2О(-2) - 4е = О2(0)
Теперь выставляем коэффициенты по диагонали, делая электронный баланс. Перед свободным кислородом ставим коэффициент (3+2) = 5, а перед перекисью и марганцовкой ставим по 4. Остальные коэффициенты получаются автоматически.
1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.