Молекулярная формула вещества: C₅H₁₀
Объяснение:
Дано:
ω%(C)=83,3%
D(воздух)=2,483
Найти молекулярную формулу-?
1. Определим молекулярную массу углеводорода:
Mr(CxHy)=D(воздух)×Mr(воздух)=2,483×29г./моль=72
2. Находим массовую долю водорода:
ω%(H)=100%-83.3%=16,7%
2. Зная массовую долю углерода, найдем его молекулярную массу в составе и количество атомов:
72 - 100%
Х - 83.3%
Х=72×83.3%÷100%=60
3. n(C) = 60 : Mr(C) = 60 : 12 =5 атомов
4. Тогда водород в составе приходится:
H= 72 - 60 = 8
5. n(H)=8 ÷ Mr(H) = 10 : 1 = 10 атомов.
6.ответ: Молекулярная формула вещества: C₅H₁₀
Відповідь:
Лучшее ибо за я ещё так не потел)
Пояснення:
А) Дано: 1. Найдем масу карбида кальция:
w(CH₃COOH)=40% | m(CaC₂)=560*95/100%=532 г
ρ(CH₃COOH)=1.4 г/см³ |
m(CaC₂)=560 г |
w(CaC₂)=5% | 2. Напишем уравнение:
Wвыхода(CH₃COOH)=90 % | 532 г х г
| CaC2 + H2O + CO2 = Ca(OH)2 +CH3COOH
V(CH₃COOH)-? | 68 г/моль 60 г/моль
Отсюда:
х=532*60/68=469,411765 г . x=m(т)
w(выхода)=m(пр)/m(т)*100%. m(пр)=90*469,411765/100%=422.470588
3. Находим масу уксусной эссенции:
w(CH₃COOH)=m(CH₃COOH)/m(раствора) ·100%
m(раствора)=m(CH₃COOH)·100%/w(CH₃COOH)
m(раствора)=422.470588*100/40=1056,17647 г
4. ρ=m/V. V=m/ρ. V(CH₃COOH)=1056,17647/1.4=754,411764 см³
Б)Дано:
m(C₂H₅NO₂)=420 г |
w(C₂H₅NO₂)=35% | 1. m(C₂H₅NO₂)=420*35/100%=147 г
m(HCl)=420 г | n(C₂H₅NO₂)=147/75=1.96 моль
w(HCl)=10.73% | 2. m(HCl)=420*10.73/100%=43.974 г
| n(HCl)=43.974/36.5=1.2048 моль
m(NH4Cl)-? | Отсюда: HCl - мало, по этому расчет за ним
w(NH4Cl)? | делаем.
Какая среда? | 43.974 г х г
NH2-CH2-COOH+HCl-->NH3Cl-CH2-COOH
36.5 г/моль 111.5 г/моль
Отсюда: х=43.974*111.5/36.5=43.974.
3. Мы имеем: m(NH3Cl-CH2-COOH)=43.974 г. n(C₂H₅NO₂)=0.7552, и водичка масой 273+376,026=649.026 г
4. Найдем масу C₂H₅NO₂, которая осталась:
m=n*M=0.7552*75=56,64 г
5. Найдем массовую долю соли в растворе:
w(NH3Cl-CH2-COOH)=m(NH3Cl-CH2-COOH)/m(раствора) ·100%
w(NH3Cl-CH2-COOH)=43.974/749,64*100%=5,866016 %
6. Среда будет кислой, ибо здесь ещё есть C₂H₅NO₂.
1. Уравнение получается следующее:
CnH2n+1COONa + NaOH = CnH2n+2 + Na2CO3
2. Находим химическое кол-во соли:
n (CnH2n+1COONa) = m/Mr =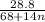 моль
моль
3. Находим химическое кол-во газа, выделившегося в ходе реакции:
n газа (CnH2n+2) = V/Vm = 0.207 моль.
4. Далее состовляем пропорцию:
0.207 — 79%
x — 100%
=> x = 0.262 моль
5. Приравниваем пункт 3. и 4. (т.к. по уравнению хим. кол-во каждого вещ-ва равно)
28.8 = 17.8 + 3.67n
3.67n = 11
n = 3 => газ — ПРОПАН
P.S. Возможны ошибки:)