13,24% сульфата цинка и 1,65% сульфата натрия
Объяснение:
К 15 процентному раствору сульфата цинка массой 75 г добавили 0,40 г натрия. Вычислите массовую долю веществ в полученном растворе
1. Найдем массу сульфата цинка в растворе:
75 г × 0,15 = 11,25 г
2. Молярная масса сульфата цинка равна 161 г/моль
3. Количество вещества ZnSO4: 11,25 г : 161 г/моль = 0,07 моль
(округленно)
4 .0,40 г натрия соответствуют 0,0174 моль
0,0174 моль 0,0174 моль
2Na + 2H2O = 2NaOH + H2↑
0,07 м 0,0174 м 0,0087 м 0,087 м
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4
Таким образом, в растворе после окончания реакции останутся:
сульфат цинка и сульфат натрия. Гидроксид цинка выпадет в
осадок.
5. Найдем массы всех веществ
m Zn(OH)2 = 99 г/моль × 0,0087 моль = 0,86 г
m Na2SO4 = 142 г/моль × 0,0087 моль == 1,23 г
Количество вещества сульфата цинка составит:
0,07 моль - 0,0087 моль = 0,0613 моль
m ZnSO4 = 161 г/моль × 0,0613 моль = 9,87 г
6. Вычислим массу раствора после реакции:
К 75 г исходного раствора прибавили 0,4 г натрия и выпал из раствора осадок массой 0,86 г
Получаем: 75 + 0,4 - 0,86 =74,54 г
7. Вычислим массовые доли веществ в растворе:
ω(Na2SO4) = 1,23 г / 74,54 г = 0,0165 или 1,65%
ω(ZnSO4) = 9,87 г / 74,54 г = 0,1324 или 13,24%
1.
А.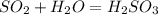
Б.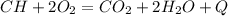
В.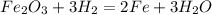
1.
А.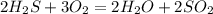
Б.
В.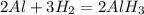
2.
mH2O = 35г
mсоли = 10г
mраствора = mсоли+mводы = 35г+10г = 45г
w = mсоли/mр-ра = 10г/45г*100% = 22,2%
2.
mр-ра = 300г
wсоли = 0,05
mсоли = w*mр-ра = 0,05*300г = 15г
mводы = mр-ра - mсоли = 300-15 = 285г
3.
C -> XH4 -> CO2 -> H2CO3
1. C + 2H2 = CH4 - соединение, обр. метан
2. CH4 + 2O2 = CO2 + 2H2O - разложение, с образованием углекислого газа и воды.
3. CO2 + H2O = H2CO3 - соединение, обр. уголная кислота
3.
Al -> Al2O3 -> Al -> Al(OH)3
1. 4Al + 3O2 = 2Al2O3 - соединение, обр. оксид алюминия.
2. 2Al2O3 --эл. ток--> 4Al + 3O2 - разложение, обр. алюминий и кислород
3. 2Al + 6H2O = 2Al(OH)3 + 3H2 - замещение, обр. гидроксид алюминия и водород.