Традиционная эмпирическая классификация веществ в химии основана на их делимости на составные части[7][10][11][12] и не использует представлений атомно-молекулярной теории. В отечественной литературе принято делить химические вещества на индивидуальные (чистые) вещества (простые и соединения) и их смеси[13][14][9][15]. На сегодняшний день стандартизированное определение индивидуального вещества отсутствует[15], поэтому в физической химии в качестве его синонима используют термин составляющее вещество[16], понимая под ним любое вещество, которое может быть выделено из системы и существовать вне её[17][18][19][20] (иногда говорят не о составляющих веществах и независимых составляющих веществах — компонентах, — а о компонентах и независимых компонентах[21][22]). Отказ от использования терминов «чистое вещество» и «индивидуальное вещество» исключает произвол, связанный с привязкой этих понятий к степени чистоты вещества и требованиям постоянства его состава и свойств.
В круглых скобках указано название вещества ()
1)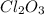 (оксид хлора(3)); Валентность: у хлора - 3, у кислорода - 2.
(оксид хлора(3)); Валентность: у хлора - 3, у кислорода - 2.
2)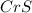 (сульфид хрома(2)); Валентность: у хрома 2, у серы 2, поэтому индексы не нужны.
(сульфид хрома(2)); Валентность: у хрома 2, у серы 2, поэтому индексы не нужны.
3)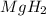 (гидрид магния); Валентность: у магния 2, у водорода - 1.
(гидрид магния); Валентность: у магния 2, у водорода - 1.
4)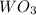 (оксид вольфрама(3)); Валентность: у вольфрама - 6, у кислорода 2.
(оксид вольфрама(3)); Валентность: у вольфрама - 6, у кислорода 2.
5)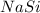 (силицид натрия); Валентность: у натрия - 1, у кремния - 1.
(силицид натрия); Валентность: у натрия - 1, у кремния - 1.
6)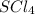 (хлорид серы(4)); Валентность: у серы - 4, у хлора 1.
(хлорид серы(4)); Валентность: у серы - 4, у хлора 1.
7)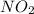 (оксид азота(4)); Валентность: у азота - 4, у кислорода - 2.
(оксид азота(4)); Валентность: у азота - 4, у кислорода - 2.
8)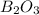 (оксид брома); Валентность: у брома - 3, у кислорода - 2.
(оксид брома); Валентность: у брома - 3, у кислорода - 2.