Говорю сразу. Я расписываю все действия подробно. Если тебе нужно тупо решение - под рассуждениями - действия как они должны быть на бумаге. Остальное можно не читать в таком случае.
Дано:
Уравнениие реакции: Ca + 2H2O >>> Ca(OH)2 + H2↑
пояснение к уравнению реакции при необходимости: [кальций + вода >>> гидроксид кальция + водород]
m(Ca)= 0,8 г.
Найти: V(H2)
1) Находим моль известного нам вещества (кальция) по формуле n=m/M (где m - известная нам в дано масса, а M - молярная масса кальция) - M(Ca) = 40 г/моль
n(Ca) = 0,8 / 40 = 0,02 моль
2) Сравниваем количество моль известного вещества (кальция) и того, которое нам необходимо найти (водорода). Видим, что они реагируют 1:1 (т.е. коээфициенты перед веществами в уравнении реакции отсутствуют (это всё равно что 1:1))
т.к. n(Ca)=n(H2)= 1:1 ⇒ n(H2)= 0,02 моль
3) Находим объём водорода по формуле V=n*Vm (где n - известные нам моль вещества, а Vm - всегда равно 22,4)
V(H2) = 0,02 * 22,4 = 0,448 л.
ответ: V(H2)= 0,448 л. = 448 мл.
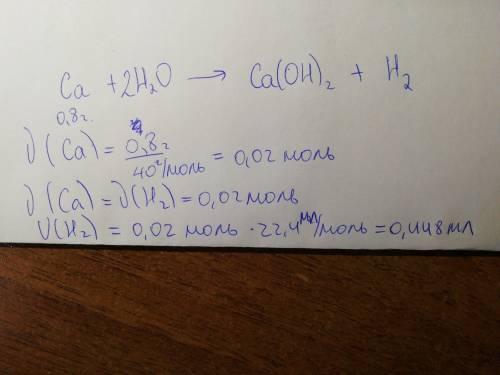
Дано:
V(O₂)=33,6л.
Vm=22,4л./моль
V(CO₂)-? V(N₂)-?
1. Определим количество вещества в 33,6л. кислорода:
n₁(O₂)=V(O₂)÷Vm
n₁(O₂)=33,6л.÷22,4л./моль=1,5моль
2. 4C₂H₅NH₂+15O₂=8CO₂+2N₂+14H₂O
по уравнению реакции:
n(O₂)=15моль n(CO₂)=8моль n(N₂) =2моль
по условию задачи:
n₁(O₂)=1,5моль n₁(CO₂)=0,8моль n₁(N₂) =0,2моль
3. Определим объем углекислогно газа количеством вещества 0,8моль:
V(CO₂)=n₁(CO₂)xVm
V(CO₂)=0,8мольх22,4л./моль=17,92л.
4. Определим объем азота количеством вещества 0,2моль:
V(N₂)=n₁(N₂)xVm
V(N₂)=0,2мольх22,4л./моль=4,48л.
5. ответ: при сгорании этиламина в кислороде 33,6л. образуется 17,92л. углекислого газа и 4,48л. азота.
Его формула C57H110O6
Ar(C)=12•57=684
Ar(H)=1•110=110
Ar(O)=16•6=96
Mr=684+96+110=890
W(C)=684•100/890=77%
W(H)=110•100=12%
W(O)=96•100/890=11%