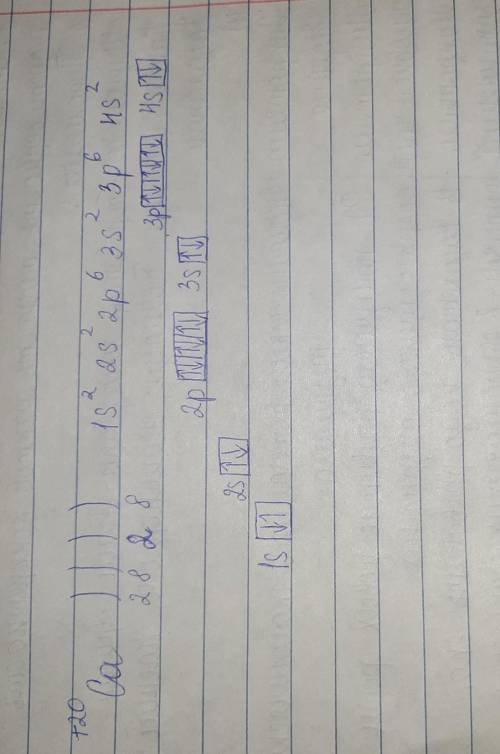Разберем на примере 1 задачи
Дано: m(O₂) = 4,8 г
m(O₃) = 4,8 г
Найти: М(смеси) - ?
1) Находим молярную массу каждого компонента:
- озона - М(О₃) = 3*16 = 48 г/моль
- кислорода М(О₂) = 2*16 = 32 г/моль
2) Находим количество молей каждого из компонентов:
- озона n(О₃) = m(O₃) / М(О₃) = 4,8/48 = 0,1 моль
- кислорода n(О₂) = m(O₂) / М(О₂) = 4,8/32 = 0,15 моль
3) Так как 1 моль любого газа при н.у. занимает одинаковый объём, а именно 22,4 дм³, то не переводя моли в объем находим объемную долю каждого компонента:
Всего молей смеси : n(смеси) = 0,1 + 0,15 = 0,25 моль
Объемная доля озона:
φ(О₃) = n(О₃) / n(смеси) = 0,1 / 0,25 = 0,4
Объёмная доля кислорода:
φ(О₂) = n(О₂) / n(смеси) = 0,15/ 0,25 = 0,6
4) Средняя молярная масса рассчитывается на основе объемных долей составляющих эту смесь газов и их молярных масс:
М(смеси) = n(О₃) * М(О₃) + n(О₂) * М(О₂) = 0,4*48 + 0,6*32 = 19,2 + 19,2 = 38,4 г/моль
Остальные задачи решаются аналогично
1 c.( 1s22s22p4)
2. d (k-)
3. ответ на фотке.
4. а) ἰόν «идущее») — атом или молекула, которая имеет электрический заряд. ... Если ион имеет положительный заряд, он называется катионом, а если отрицательный — анионом.
б) Катион кальция образуется при отдаче ē атомом, приобретая заряд положительный.
5. а) NaCl, CaCl2, AlCl3.
б) FeO , Fe2O3.
6. а) Mr(Fe2O3)=160г/м
w(Fe) = 112/160×100%=70%
w(O) = 48/160×100%=30%
б) Ar(Al) = 27, Ar(O) = 16
Mr(Al2O3) = 27*2 + 16*3 = 102
W(Al) = Ar(Al) *n / Mr(Al2O3) *100% = 27*2 / 102 *100% = 53%
W(O) = Ar(O) *n / Mr(Al2O3) *100% = 16*3 / 102 *100% = 47%
7. 1- в
2-а
3-г
4-б
8. 1. реакция замещения
2. реакция соединения
3. реакция разложения
4. реакция обмена
9. 1 - Б
2 - г
3 - а
4 -в
10. а) Железо не окисляется на сухом воздухе. (1 пробирка)
Если бы во 2 пробирке не было масла, то гвоздь покрылся бы налетом ржавчины ( 2 пробирка)
б)Гвоздь ржавеет, потому что он сделан из железа, которое подвергается коррозии. Железо окисляется кислородом воздуха. (3 пробирка)
Усилению процесса окисления растворы соли. (4 пробирка).
Кислота обладает сильными окислительными свойствами (5 пробирка)
В) В случае с 5 пробиркой.
11.а) Пробирка 1 – Zn
Пробирка 2 - Fe
б) Zn + 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2 + H2
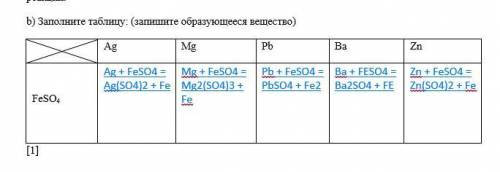
12. a). AgNO3 +; HCl+; ZnSO4-; H2O+.
Б) таблицу прикреплю ниже, чтобы понятнее было
Объяснение: