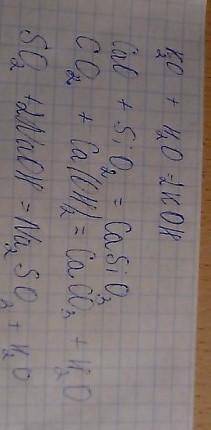
Уравнение реакции:
CaCl2+Na2CO3=CaCO3+2NaCl
Так как указано количество только соды, считаем что хлорид кальция находится в избытке или стехиометрическом соотношении и расчет количества продукта реакции рассчитываем по соде.
Атомный вес натрия Na=23
Атомный вес углерода С=12
Атомный вес кислорода О=16
Атомный вес кальция Ca=40
Молярный вес кальцинированной соды Na2CO3=23*2+12+16*3=106
Молярный вес карбоната кальция CaCO3=40+12+16*3=100
Мы взяли 200 граммов 5,3% раствора соды. Проценты - это количество вещества в 100 граммах смеси.
Таким образом мы взяли 200*5,3/100=10,6 граммов чистой 100% соды.
Теперь составляем пропорцию с учетом стехиометрических коэффициентов:
106 - 100
10,6 - Х
Х=10,6*100/106=10 граммов соды.
ответ: в результате данной реакции мы получим 10 граммов карбоната кальция.
Подробнее - на -
Объяснение:
C6h10o5+h2o=c6h12o6
C6h12o6=2C2H6O+2Co2 (брожение)
находим массу крахмала
m(C6H10O5)=m(картофеля) * W(C6h10o5)=5000 *0.2=1000 г
n(C6H10O5)=m / M=1000 / 162=6.172 моль
n(C6H12O6) = n (C6h10O5)
n(C2H6O) *2 = n(C6H12O6)
n(C2H6O)=6.172 *2=12.345 моль
m(C2H6O)= n*M=12.345 *46=567.9 г
находим массу раствора этанола по условию задачи
m=PV=450*0.8=360 г
находим массу этанола
m(c2h6o)=W (c2h6o) * m (р-ра)=360*0.95=342 г
выход находим по формуле :
W(Выход)=m(практ.) / m(теор.) практ- по условию теор - по расчётам
W(C2H6O)выход = m(практ) / m(теор.)= 342 / 567.9=0.6022
60.22%
Подробнее - на -
Объяснение:
спс
Объяснение: