
Нет.
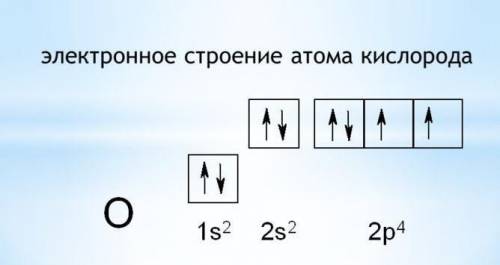
У Кислорода на внешнем уровне(2 уровень), в подуровне р-, два электрона без пары, за счёт них образуются стабильные две связи — валентность II всегда.
У Серы есть ещё и третий уровень, в котором есть s-, p- и d- подуровни. Поэтому у серы больше валентностей. В возбуждённом состоянии сера может проявлять валентность IV и VI кроме II.
Под n на рисунке подразумевается номер уровня.
16S 1s2 2s2 2p6 3s2 3p4 — валентность II, H2S;
16S* 1s2 2s2 2p6 3s2 3p3 3d1 — валентность IV, SO2;
16S** 1s2 2s2 2p6 3s1 3p3 3d2 — валентность VI, Na2SO4
На рисунке представлен внешний электронный уровень у серы в соединениях, указанных в качестве примеров.
У кислорода валентность II ВСЕГДА. Что в простом веществе O2, что в соединении H2O

Объяснение:
Осторожно! яд! как известно, в природе сера часто встречается в соединениях с металлами в форме сульфидов металлов. широко используемый в лабораториях сульфид железа fes представляет собой голубовато-черную массу. мы получим его, если смешаем 20 г чистого порошка железа с 11 г порошка серы (серного цвета) и нагреем на огнеупорной подложке. будем перемешивать смесь, чтобы она равномерно прокалилась. после охлаждения получим твердый остаток. сульфид железа используют для получения сероводорода, который применяют в анализе для осаждения металлов. поместим в пробирку немного (с горошину) полученного сульфида железа и добавим разбавленной соляной кислоты. вещества взаимодействуют с бурным выделением газа: fes + 2нсl = h2s↑ + fecl2 из пробирки доносится неприятный запах тухлых яиц - это улетучивается сероводород