1.Позначте правильне твердження щодо системи, в якій встановилася рівновага, що описується рівнянням N2 + 3H2 = 2NH3 ∆Н= -92 кДж А при підвищенні тиску рівновага зміщується в бік продуктів реакції
Б при підвищенні температури рівновага зміщується в бік продуктів реакції
В при збільшенні концентрації азоту рівновага зсувається в бік реагентів
Г при зменшенні концентрації амоніаку рівновага зсувається в бік реагентів
2.Укажіть умови, за яких можна змістити хімічну рівновагу оборотної реакції в напрямку прямої реакції СО2 (г) + Н2(г) ↔СО(г) + Н2О (г), ∆Н = - 41 кДж
А підвищити тиск; Б знизити температуру; В зменшити концентрацію чадного газу;
Г збільшити концентрацію водню
3. Укажіть назву речовини, у водному розчині якої колір універсального індикаторного папірця змінився на рожевий
А натрій хлорид; Б натрій карбонат; В ферум(ІІІ) сульфат; Г цинк карбонат
4. Позначте речовини, при взаємодії яких утворюється газоподібна речовини
А цинк гідроксид та натрій гідроксид; Б арґентум нітрат та калій хлорид;
В кальцій карбонат та нітратна кислота; Г натрій хлорид та калій нітрат
5. Збільшення тиску в системі спричинить підвищення виходу продукту в реакції
А 2H2O(г.) ↔ 2H2(г.) + O2 (г.) ; Б CaCO3 (тв.) ↔ CaO(тв.) +CO2(г.)
В N2 (г.) + 3H2 (г.) ↔ 2 NH3(г.) Г CO(г.) + H2O(г.) ↔ CO2(г.) + H2(г.)
6. Проаналізуйте твердження. Чи є проміж них правильні.
І. Позитивно заряджений електрод гальванічного елемента називається анод.
ІІ. Під час роботи гальванічного елемента катод розчиняється.
А правильне тільки І; Б правильне тільки ІІ; В обидва правильні; Г немає правильних
7. Установіть відповідність між явищем, що свідчить про перебіг хім. реакції та її реагентами
Явище
Реагенти
1 утворення осаду
А натрій нітрат і калій сульфат
2 виділення газоподібної речовини
Б натрій сульфат і барій хлорид
3 утворення малодисоційованої речовини
В ортофосфатна кислота і натрій гідроксид
4 реакція не відбувається
Г калій карбонат і хлоридна кислота
Д натрій гідроксид і калій хлорид
8. Установіть відповідність між схемами та типами хімічних реакцій
Схема реакції
1 MgO + HCl → MgCl2 + H2O
2 BaO + H2O → Ba(OH)2
3 Fe+ HCl → FeCl2 + H2
4 CaCO3 → CaO + CO2
Тип реакції
А заміщення
Б сполучення
В обміну
Г розкладу
Д дегідратації
9. Якою є реакція середовища водних розчинів калій хлориду, цинк нітрату та натрій сульфіту? Відповідь обґрунтуйте за до рівнянь реакцій гідролізу.
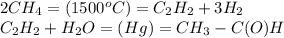
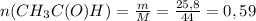 моль
моль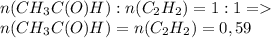
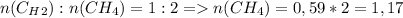 моль
моль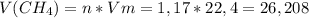 л
л
У любого газа есть такое понятие как "количество вещества", которое измеряется в молях. Оно вычисляется по формуле:
n=V/Vm,
где n - количество вещества [моль],
V - объем вещества [литр]
Vm - молярный объем, Vm=22,4 [моль/л], т.е. в объеме 22,4 л содержится 1 моль любого газа (при нормальных условиях, т.е. нормальном давлении и нормальной температуре).
У любого не газообразного вещества тоже есть понятие "количества вещества", и тоже измеряется в молях, но тут другая формула:
n=m/M,
где m - масса вещества [граммы]
М - молярная масса [грамм/моль], молярную массу любого вещества высчитывают путем сложения атомных масс всех входящих в вещество элементов с учетом индексов, например M(H₂SO₄)= 2×1 + 32 + 4×16= 98 г/моль. Значения атомных масс для каждого элемента записаны в таблице Менделеева.
Итак, вне зависимости от того, что нам дано в условии задачи, мы всегда можем найти молярный объем для любого газа (Vm) и молярную массу для твердого вещества (М).
Все задачи на нахождение объема газа, необходимого для реакции с определенным количеством другого вещества решаются через пропорции. Например:
какой объем водорода выделится при взаимодействии алюминия с раствором серной кислоты, содержащим 9,8 г H₂SO₄.
Последовательность решения задачи:
1) пишем уравнение реакции
2) пишем, что нам известно, или что мы можем подсчитать самостоятельно.
3) составляем пропорцию
1) уравнение реакции: 2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂
2)Нам дано:
m(H₂SO₄)= 3,65 г
Сами мы можем найти:
М(H₂SO₄)= 2×1 + 32 + 4×16= 98 г/моль
Vm (H₂)= 22,4 л/моль
3) составляем пропорцию по уравнению реакции, для этого объединяем известные нам данные с неизвестным (которое принимаем за х)
Т.к. по уравнению реакции у нас 3 моль H₂SO₄ дают 3 моль H₂, то в пропорции мы это обязательно должны учесть:
3 моль×98 г/моль H₂SO₄ дают 3 моль×22,4 л/моль H₂, после перемножения и сокращения моль получаем:
294 г H₂SO₄ дают 67,2 л H₂
9,8 г H₂SO₄ дают х л H₂
Откуда: