У розчин аргентум(І) нітрату масою 85 г з масовою часткою солі 2 % занурили цинкову пластинку. Обчисліть масу срібла, що виділиться на пластинці після закінчення реакції.
Щелочные металлы одновалентны. запишем уравнение реакции в общем виде (обозначая неизвестный элемент и его молярную массу как х). 2x+2h2o--> 2xoh+h2 ↑ найдем количество водорода. n(h2)=v(h2)/vm=2,8л/22,4л/моль=0,125 моль. при этом по уравнению реакции выходит, что количество щелочи в два раза больше. n(xoh)=2*0,125моль=0,25 моль с другой стороны, n(xoh)=m/m=m(p-p)*w(xoh)/m(xoh)=500г*0,028/(x+17)г/моль=14/(x+17) моль составим уравнение: 14/(x+17)=0,25 0,25x+4,25=14 x=39 то есть молярная масса элемента х равна 39 г/моль. это соответствует калию k. его порядковый номер - 19.
Дано:
n(Zn) = 0,2 моль
Найти:
m(Zn) - ?
n =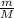 ⇒ m = n * M
⇒ m = n * M
M(Zn) = Ar(Zn) = 65 г/моль
m(Zn) = 0,2 моль * 65 г/моль = 13 г.
ответ: m(Zn) = 13 г.2)Дано:
N(MgO) = 3 * 10²³ частиц
Найти:
m(MgO) - ?
n(MgO) - ?
n(MgO) = =
=  ≈ 0,5 моль
≈ 0,5 моль
m(MgO) = n * M
M(MgO) = Ar(Mg) + Ar(O) = 24 * 16 = 40 г/моль
m(MgO) = 0,5 моль * 40 г/моль = 20 г.
ответ: n(MgO) ≈ 0,5 моль, m(MgO) = 20 г.3)Дано:
m(CO₂) = 22 г.
Найти:
n(CO₂) - ?
N(CO₂) - ?
n(CO₂) =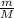
M(CO₂) = Ar(C) + Ar(O) * 2 = 12 + 16 * 2 = 12 + 32 = 44 г/моль
n(CO₂) = 22 г. / 44 г/моль = 0,5 моль
N(CO₂) = n * N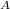 = 0,5 моль * 6,02 * 10²³ моль⁻¹ = 3,01 * 10²³ частиц
= 0,5 моль * 6,02 * 10²³ моль⁻¹ = 3,01 * 10²³ частиц
ответ: n(CO₂) = 0,5 моль, N(CO₂) = 3,01 * 10²³ частиц.4)Дано:
N(Br₂) = 12 * 10²³ частиц
Найти:
m(Br₂) - ?
n(Br₂) - ?
n(Br₂) = =
= 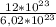 ≈ 2 моль
≈ 2 моль
m(Br₂) = n * M
M(Br₂) = Ar(Br) * 2 = 80 * 2 = 160 г/моль
m(Br₂) = 2 * 160 = 320 г.
ответ: n(Br₂) = 2 моль, m(Br₂) = 320 г.5)Дано:
m(H₂SO₄) = 98 г.
Найти:
N(H₂SO₄) - ?
n(H₂SO₄) - ?
n(H₂SO₄) =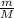
M(H₂SO₄) = Ar(H) * 2 + Ar(S) + Ar(O) * 4 = 1 * 2 + 32 + 16 * 2 = 2 + 32 + 32 =
68 г/моль
n(H₂SO₄) = 98 г. / 68 г/моль ≈ 1,5 моль
N(H₂SO₄) = n * N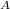 = 1.5 моль * 6,02 * 10²³ моль⁻¹ = 9,03 частиц
= 1.5 моль * 6,02 * 10²³ моль⁻¹ = 9,03 частиц
ответ: n(H₂SO₄) ≈ 1,5 моль, N = 9,03 частиц