FeCl3→Fe(OH)3→Fe2O3→Fe(NO3)3→FePO4
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl2Fe(OH)3 → Fe2O3 + H2OFe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2OFe(NO3)3 + H3PO4 → FePO4 + 3HNO31) 4FeS2 + 11O2 = 8SO2 + 2Fe2O3 M(FeS2) = 120 г/моль
n(SO2) = 2 n(FeS2) по уравнению реакции
переводим массу руды в г: m(руды) = 1х10^6 = 100x10^4 г
100x10^4 г - 100%
m(FeS2) - 48%, m(FeS2) = 48х10^4 г
n(FeS2) = m/M = 480x10^3 / 120 = 4x10^3 моль (4000 моль)
n(SO2) = 2x4000 = 8000 моль
2) Пусть 1 л воды при н.у. равен 1 кг, тогда m(H2O) = 20 кг = 20х10^3 г
V(H2S) = 44,8 л M(H2S) = 34 г/моль, M(H2O) = 18 г/моль
n(H2S) = V/Vm = 44,8/22,4 = 2 моль
m(H2S) = n * M = 2 * 34 = 68 г
20000 г - 100%
68 г - W %
W р-ра = 6800/20000 = 0,34%
FeCl₃+3NaOH=Fe(OH)₃+3NaCl
Дано:
m(NaOH)=360г.
+
FeCl₃
----------------------------
Fe(OH)₃ - ?
===================
P.S (При написании задания вы скорее всего допустили опечатку, ведь, об остатке в этом задании речи идти не может, а об ОСАДКЕ, очень даже, ведь Fe(OH)₃ красно-коричневый осадок.)
===================
1) Найдем кол-во вещества NaOH:
n = m : M
n = 360г : 40г/моль = 9 моль
2) Теперь по пропорции найдем кол-во вещества нашего осадка Fe(OH)₃:
n(Fe(OH)₃)= 3 моль
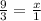
3x = 9
x = 3 моль
3) Найдем массу Fe(OH)₃ по формуле:
m = M * n
m = 107г/моль * 3 моль = 321г.
ответ: 321г.
Fe Cl³(снизу3) + 3КОН =Fe(OH) (снизу3) + 3 КСl
2Fe (OH) (снизу3) =Fe2 (снизу2) О(снизу3) +3Н(снизу2) О (t)
Fe2 О3(снизу 3;2) +6НNO3 =2Fe(NO3) +ЗН2О
(все цифры например2 или 1,3 пиши снизу)