27 г у л
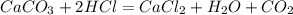
100 г 22,4 л
1.Определим чистую массу карбоната кальция в известняке:
30 г известняка - это 100%, а
х г________________90%, откуда х=30*90/100=27 г
2. По этой массе,подставив ее в уравнение реакции,и определим объем углекислоо газа:
при взаимодействии 100 г карбоната образуется 22,4 л углекислого газа, а
при --//--//-- 27 г___________________у л, откуда
у=27*22,4/100=приблизительно 6 л
Задача сложная, но банальная:D
Уравнение реакции:
K2CO3 + ZnCl2 = 2KCl + ZnCO3(осад.)
Рассчитаем количество вещества карбоната калия(с молярной концентрации):
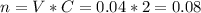 моль
моль
Рассчитаем количество вещества хлорида цинка(я рассчитываю сразу, подставляя и плотность и объем и массовую долю, дела на молярную массу):
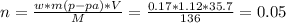 моль
моль
Видим,что карбонат калия в избытке, в количестве:0,08 - 0,05 = 0,03 моль
Рассчитаем массу избыточного карбоната калия:
m = n*M = 0,03моль*138г/моль = 4,14г
По уравнению реакции:
n(KCl) = 2n(ZnCl2) = 0,05моль*2 = 0,1моль
Рассчитаем массу хлорида калия:
m = n*M = 0,1моль*74,5г/моль = 7,45г
По уравнению реакции:
n(ZnCO3) = n(ZnCl2) = 0,05моль
Рассчитаем массу карбоната цинка:
m = n*m = 0,05моль*125г/моль = 6,25г
Рассчитаем массу получившегося раствора:
m(р-ра) = m(р-ра K2CO3) + m(р-ра ZnCl2) - m(ZnCO3) = ((1,3г/мл*40мл) + (35,7мл*1,12г/мл) - 6,25г = 85,75г
Рассчитаем массовые доли хлорида калия и непрореагировавшего карбоната калия:
w(KCl) = 7,45г/85,75г*100% = 8,68%
w(K2CO3) = 4,14г/85,75г*100% = 4,82%
условно обозначу кол-во в-ва буквой u
u(CH4)=80/16=5 моль
u(CH4)/u(H2)=1/2=5/x
x=10 моль
V(H2)=10*22,4=224 литра