Для удобства положим, что масса раствора равна 100 г.
1) Тогда масса дихромата = 10 г, а оставшаяся часть воды = 90 г.
Если смешивают в отношении 1:2, это значит, что на одну массу раствора приходится смешивать две массы воды. Если масса раствора 100 г, значит еще нужно добавить 200 г воды. В итоге имеем 290 г воды в растворе + 10 г дихромата. Т.е. 300 г - масса раствора. Отношение посчитать несложно - 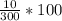 ≈ 3.33 %
≈ 3.33 %
2) Здесь рассуждаем аналогично. В первом растворе на 100 г раствора приходится 10 г дихромата, все остальное - это вода. Во втором растворе на 100 г раствора приходится 7 г дихромата и 93 г воды.
Коль их смешивают в отношении 1:2, то масса раствора должна быть равной 300 г (100 г с первого раствора + 200 г со второго)
На 200 г второго раствора приходится 14 г дихромата и 186 г воды.
Масса дихромата в итоговом растворе получилась равной 14 + 10 = 24 г
Масса раствора = 300 г
Итого: 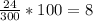 %
%
ответ: 1) 3.33% 2) 8%
1)Получение .-аспарагиновой кислоты
В качестве носителя можно использовать полистирол, частично сшитый дифениловыми мостиками. Проведя хлорметилирование такого полимера и обработав его затем -гистидином, удалось в присутствии солей двухвалентной меди получить пролин 94%-ной оптической чистоты, а аспарагиновую кислоту с оптической чистотой 35%. Наиболее эффектный результат получен на хлорметилированном сополимере стирола и дивинилбензола с закрепленным на нем -пролином пропуская через подобную колонку сначала соли меди, а затем рацемический пролин, удается расщепить его с 100%-ным выходом и 100%-ной оптической чистотой.
2) Глутами́новая кислота́ (2-аминопентандио́вая кислота) — органическое соединение, алифатическая двухосновная аминокислота, входящая в состав белков всех известных живых организмов.
В биохимической литературе вместо громоздкого полного названия часто используют более компактные конвенциональные обозначения: «глутамат», «Glu», «Глу» или «E». Вне научной литературы термин «глутамат» также часто употребляется для обозначения широко распространённой пищевой добавки глутамата натрия.
В живых организмах остаток молекулы глутаминовой кислоты входит в состав белков, полипептидов, в некоторые низкомолекулярные вещества и присутствует в свободном виде. При биосинтезе белка включение остатка глутаминовой кислоты кодируется кодонами GAA и GAG.
Глутаминовая кислота играет важную роль в метаболизме азотсодержащих биохимических веществ[источник не указан 547 дней]. Она также является нейромедиаторной аминокислотой, одной из важных представителей класса «возбуждающих аминокислот»[2].
Связывание глутаминовой кислоты со специфическими рецепторами нейронов приводит к их возбуждению[источник не указан 547 дней].
Глутаминовая кислота относится к группе заменимых аминокислот, в человеческом организме синтезируется.
Соли и сложные эфиры глутаминовой кислоты называются глутаматы.
ответ: 1.12 дм куб.