1) Гидрирование (с образованием первичных спиртов):
H₃C-COH+H₂→H₃C-CH₂-OH
2) Присоединение гидросульфита натрия (только для алициклических):
H₃C-COH+NaHSO₃→H₃C-C-SO₃Na
|
OH
3) Присоединение синильной кислоты (образование гидроксинитрилов, или циангидринов): H₃C-COH+HCN→H₃C-CH-CN
|
OH
4) Присоединение спиртов (образование ацеталей):
R-COH+H₃-CH₂-OH⇄R-CH-O-CH₂-CH₃
| полуацеталь
OH
R-CH-O-CH₂-CH₃ R-CH-O-CH₂-CH₃
| +H₃C-CH₂-OH⇄ | ацеталь
OH O-CH₂-CH₃
5) Гидратация: CH₂=O+H₂O→H₂C(OH)₂ гидрат формальдегида
6) Присоединение реактива Гриньяра:
R-COH+H₃C-CH₂-MgI→R-CH-CH₂-CH₃
|
O-MgI
R-CH-CH₂-CH₃ R-CH-CH₂-CH₃
| +H₂O→ | +Mg(OH)I
O-MgI OH
7) Полимеризация (циклическая и линейная)
7.1) линейная: под действием света происходит линейная полимеризация 40%-ного водного раствора формальдегида с образованием параформа (картинка внизу).
7.2) циклическая: альдегиды самопроизвольно или под действием кислот могут вступать в реакции тримеризации и тетрамеризации, при этом образуются шести- и восьмичленные циклы с чередующимися атомами углерода и кислорода в молекуле (картинка внизу).
8) Поликонденсация: реакции поликонденсации – это процесс образования полимеров из низкомолекулярных веществ, сопровождающийся отщеплением побочных низкомолекулярных веществ – воды, спирта, галогеноводородов и т.д. Альдегиды вступают в реакцию поликонденсации с фенолом (анилином и т.д.) с образованием соответствующих полимерных смол. Реакции протекают ступенчато: сначала образуется димер, затем тример и т.д. (картинка внизу).
9) Конденсация (картинка внизу).
10) Горение: CnH2nO+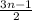 O₂→nCO₂↑+nH₂O
O₂→nCO₂↑+nH₂O
11) Реакции окисления. Альдегиды легко окисляются до кислот даже слабыми окислителями, такими как аммиачный раствор оксида серебра (Ag₂O/NH₃, или [Ag(NH₃)₂]OH), а также свежеосажденным гидроксидом меди (II):
11.1) реакция "серебряного зеркала": R-COH+2[Ag(NH₃)₂]OH→R-COONH₄ (или RCOOH) + 2Ag↓+3NH₃↑ (или 4NH₃↑)+H₂O
Исключение для формальдегида: HCOH+4[Ag(NH₃)₂]OH→(NH₄)₂CO₃+4Ag↓+6NH₃↑+2H₂O
11.2) R-COH+2Cu(OH)₂→R-COOH+Cu₂O↓+2H₂O
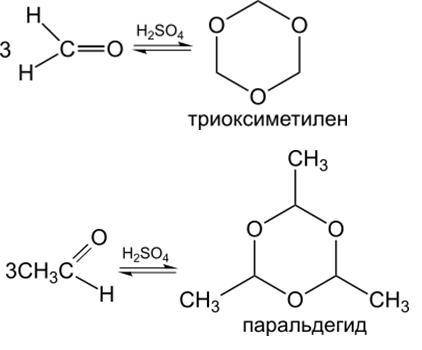
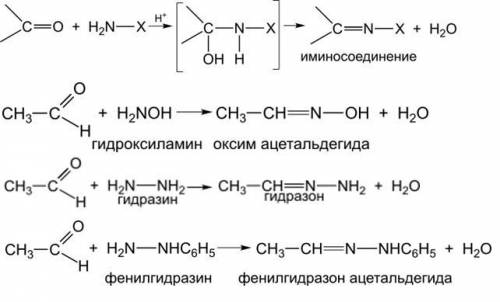
12) Реакции замещения с соединениями, содержащими аминогруппу (картинка внизу).
13) Взаимодействие с пентахлоридом фосфора:
R-COH+PCl₅→R-CH-Cl+POCl₃
|
Cl
14) Замещение атома водорода в радикале в α-положении к карбонильной группе (например, галогенирование). Сильно поляризованная карбонильная группа в молекулах альдегидов и кетонов вызывает понижение электронной плотности (δ+) на атомах углерода в α-положении, вследствие чего атомы водорода приобретают повышенную реакционную и могут отщепляться в виде протона:
H₃C-CH₂-CH₂-COH+Br₂→H₃C-CH₂-CH-COH+HBr
|
Br



Короче не знаю, что именно тебе нужно , но вот :
Особенности органических соединений
В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
1) атомы углерода соединяться друг с другом;
2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Особенности атома углерода объясняются его строением:
1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Структурные формулы – это язык органической химии.
В структурных формулах ковалентная связь обозначается черточкой. Как и в структурных формулах неорганических веществ, каждая черточка означает общую электронную пару, связывающую атомы в молекуле. Используются также эмпирические и электронные формулы.
Классификация органических соединений
В зависимости от строения углеродных цепей среди органических соединений выделяются следующие три ряда:
1) соединения с открытой цепью атомов углерода, которые также называются ациклическими, или соединения жирного ряда (это название возникло исторически: к первым соединениям с длинными незамкнутыми углеродными цепями принадлежали кислоты).
В зависимости от характера связей между атомами углерода эти соединения подразделяются на: а) предельные (или насыщенные), которые содержат в молекулах только простые (ординарные) связи; б) непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода;
2) соединения с замкнутой цепью атомов углерода, или карбоциклические. Эти соединения, в свою очередь, подразделяются:
а) на соединения ароматического ряда.
Они характеризуются наличием в молекулах особой циклической группировки из шести атомов углерода – бензольного ароматического ряда.
Эта группировка отличается характером связей между атомами углерода и придает содержащим ее соединениям особые химические свойства, которые называются ароматическими свойствами;
б) алициклические соединения – это все остальные карбоциклические соединения.
Они различаются по числу атомов углерода в цикле и в зависимости от характера связей между этими атомами могут быть предельными и непредельными;
3) гетероциклические соединения.
Виды органических соединений:
1) галогенопроизводные углеводороды: а) фторпроизводные; б) хлорпроизводные; в)бромопроизводные, г) йодопроизводные;
2) кислородосодержащие соединения: а) спирты и фенолы; б) простые эфиры; в) альдегиды; г) кетоны.
8. Типы органических соединений
Органические реакции, как и неорганические, подразделяются на 3 основных типа:
1) реакция замещения: СН4 + CI2 → СН3CI + НCI;
2) реакция отщепления: СН3СН2Br → СН2 = СН2 + НBr;
3) реакция присоединения: СН2 = СН2 + НBr → CН3СН2Br.