Фтор – элемент, относящийся к группе галогенов. Неметалл. Расположен во втором периоде VII группы A подгруппы.
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной среди всех элементов Периодической системы.Условное изображение строения атома фтора
https://ru-static.z-dn.net/files/d67/d646eded0e2dd73ca5636cb90eea927c.jpg
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
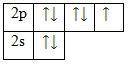
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
https://ru-static.z-dn.net/files/d74/45577a2d36e79463f2cccd9a8fe3a6ad.jpg
Энергетическая диаграмма для валентных электронов
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.
Объяснение:

C6H5NO2 + 3Н2 --> C6H5NH2 + 2H2O
M (нитробензола) = 123г/моль
М (анилина) = 93г/моль
М (Н2) = 2г/моль
n (нитробензола) = 493/123=4,01 моль
n (Н2) = 24/2= 12 моль
согласно уравнению химической реакции на 1 моль нитробензола приходится 3 моль водорода, следовательно на 4,01 моль нитробензола потребуется 12,03 моль. А водорода всего 12 моль. Значит водород в недостатке, нитробензол в избытке (избыток = 0,01 моль).
Расчет ведем по недостатку (по водороду):
их 3 моль водорода образуется 1 моль анилина, из 12 моль получим 12/3=4 моль анилина.
с учетом выхода 10%: 4моль*10%/100%=0,4моль
m (анилина) = 0,4 моль * 93г/моль = 37,2г
ответ: анилина 0,4моль или 37,2г