а)
Дано :
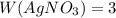 %.
%.
m(раствора) = 10 г.
-
Найти :
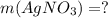
-
m(вещества) = (W(вещества) * m(раствора)) / 100 %.
m(AgNO₃) = (W(AgNO₃) * m(раствора)) / 100 % = (3 % * 10 г) / 100 % = 30 г/100 = 0,3 г.
Теперь ищем массу нитрата серебра в пункте б.
б)
Дано :
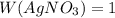 %.
%.
m(раствора) = 30 г.
-
Найти :
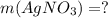
-
m(вещества) = (W(вещества) * m(раствора)) / 100 %.
m(AgNO₃) = (W(AgNO₃) * m(раствора)) / 100 % = (1 % * 30 г) / 100 % = 30 г/100 = 30 г.
Как видим, массы нитратов алюминия в двух пунктах совпадают. То есть, ответ на вопрос задачи : "Да".
ответ : да.
9,8 г Х г, Х л
H2SO4 + CaCO3 = CaSO4 + CO2 + H2O
n = 1 моль n = 1 моль
Mr = 98 г/моль Mr = 44 г/моль Vm=22,4 л/моль
m = 98 г m = 44 г V = 22,4 л
9,8 г H2SO4 - Х г СО2
98 г H2SO4 - 44 г СО2
m(CO2) = 9,8 * 44 /98 = 4,4 г
9,8 г H2SO4 - Х л СО2
98г H2SO4 - 22,4 л СО2
V(CO2) = 9,8 * 22,4 / 98 = 2,24 л