1) Обозначим массу 35%-ного раствора через Х граммов. Тогда масса 15%-ного раствора равна (200 - Х) граммов.
2) Если концентрацию раствора выразить в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах, ω - массовая доля растворенного вещества, выраженная в долях единицы.
35% - это 0,35 в долях единицы., 15% - 0,15, 20% - 0,2.
3) Так как при смешении растворов массы растворенных веществ объединяются, то можем записать:
0,35 * Х + 0,15 * (200 - Х) = 0,2 * 200
0,35 Х + 30 - 0,15Х = 40
0,2Х = 10
Х = 50 граммов
4) Тогда 15%-ного раствора нужно: 500 - 50 = 150 г
ответ: 50 г 35%-ного р-ра
150 г 15%-ного р-ра
Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
ответ: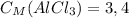 моль/л
моль/л