ZnS + 2HCl → ZnCl2 + H2S↑
2H⁺2S⁻² + 3O⁰2 (изб.)→(t°) 2S⁺⁴O⁻²2↑ + 2H⁺2O⁻²
S⁻² -6e → S⁺⁴ | 2 | (восстановитель/окисление)
O⁰2 +4e → 2O⁻²| 3 | (окислитель/восстановление)
H2S является восстановителем, O2 является окислителем.
2S⁺⁴O⁻²2 + O⁰2 →(t°, кат) 2S⁺⁶O⁻²3
S⁺⁴ - 2e → S⁺⁶ | 2 | (восстановитель/окисление)
O⁰2 + 4e → 2O⁻² | 1 | (окислитель/восстановление)
SO2 является восстановителем, O2 является окислителем.
SO3 + H2O (холодная)→ H2SO4
Ba(OH)2 + H2SO4 (разб.)→ BaSO4 + 2H2O
Ba²⁺ +2OH⁻ +2H⁺ +SO4²⁻ → BaSO4 + 2H2O
Объяснение:
m(FeCl₃)=11.739 г.
Объяснение:
Начнем с того, что приведем все величины к одним и тем же единицам измерения. Если у нас концентрация (с) хлорида железа (III) = 0,42 моль/дм³, то Vр-ра = 0,172 дм³.
Формула, которая связывает концентрацию и объем раствора выглядит вот так:
с(в-ва) = n(в-ва) ÷ V(р-ра) ⇒ n(в-ва) = с(в-ва) × V(р-ра)
Отсюда получаем, что n(FeCl₃) = c(FeCl₃) × V(р-ра) = 0,42 моль/дм³ × 0,172 дм³ = 0,07224 моля.
Ну и тут уже классика - m(в-ва) = n(в-ва) × M(в-ва) ⇒ m(FeCl₃) = n(FeCl₃) × M(FeCl₃), где M(FeCl₃) = M(Fe) + M(Cl)×3 = 56 г/моль + 35.5×3 г/моль = 162, 5 г/моль.
Подставим все имеющиеся значения и получим - m(FeCl₃) = 0,07224 моля × 162,5 г/моль = 11,739 г.
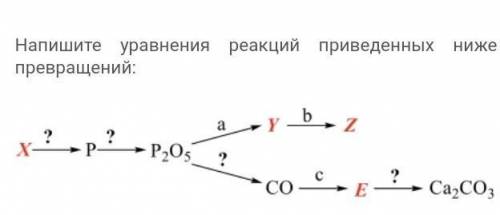
1) 2PH₃ (t°C) → 2P + 3H₂↑
2) 4P + 5O₂ (t°C) → 2P₂O₅
3) P₂O₅ + 2NaOH(р) + H₂O(г) → 2NaH₂PO₄
4) NaH₂PO₄ + NaOH(р) → Na₂HPO₄ + H₂O
5) P₂O₅ + 5C (t°C) → 2P + 5CO↑
6) CO + H₂O(г) (Fe₂O₃, 500°C) → CO₂↑ + H₂↑
7) CO₂ + 2CaO → Ca₂CO₃
a - NaOH(р) + H₂O(г)
b - NaOH(р);
c - H2O(г), катализатор Fe2O3, 500ºС.
X - PH₃ - Фосфин
Y - NaH₂PO₄ - Дигидрофосфат натрия
Z - Na₂HPO₄ - Гидрофосфат натрия
E - CO₂ - Оксид углерода (IV)
? - (t°C) - в 1-ой реакций
? - O₂ - во 2-ой реакций
? - С - в 5-ой реакций
? - СaO - в 7-ой реакций
X - PH₃ - Фосфин
Y - NaH₂PO₄ - Дигидрофосфат натрия
Z - Na₂HPO₄ - Гидрофосфат натрия
E - CO₂ - Оксид углерода (IV)
? - (t°C) - в 1-ой реакций
? - O₂ - во 2-ой реакций
? - С - в 5-ой реакций
? - СaO - в 7-ой реакций