х г 0,56 л
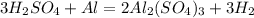
279 г 67,2 л
1. Найдем чистую массу кислоты,необходимую для образования 0,56 л водорода:
при взаимодействии 279 г кислоты выделяется 67,2 л водорода, а
при -- // -- // -- х г_____________________0,56 л, откуда
х=279*0,56/67,2=2,325 г
2. Учитывая,что полученная масса кислоты - это всего лишь 20% в растворе,тогда:
2,325 г кислоты - это 20%, а
у г раствора________100%, откуда у=2,325*100/20=11,625 или приблизительно 12 г
ответ: 64%
Объяснение:
M(LiNO3) = 69 г/моль
M(NO2)= 46 г/моль
М(О2) = 32 г/моль
Составляем УХР:
4LiNO3 = 2Li2O + 4NO2↑ + O2↑
Из УХР видно, что масса уменьшается за счет выделения газов диоксида азота и кислорода.
Для расчетов примем кол-во нитрата лития равное 4 моль
m(LiNO3) = n*M = 4*69 г/моль = 276 г
По условию задачи первоначальная масса уменьшилась на 50%, найдем данную массу:
Δm = 276 г*0,5 = 138 г
Примем кол-во разложившегося нитрата лития за х моль, тогда согласно УХР
m(NO2) = 4x*46 г
m(O2) = 32х
4*46х+32х = 138
216х=138
х=0,638889 моль
Находим массу разложившего нитрата лития:
m(LiNO3) = 4*69*0,638889 = 176,38 г
Находим степень разложения нитрата лития:
W(LiNO3) = 176,38/276*100% ≈ 64%
ответ: 64%