Масса добавленного хлорида натрия равна 28.8(8) г
Объяснение:
Дано:
m(раствора) =500 г
w(NaCl) =4.8 %
w(NaCl) =10 %
Найти
m(NaCl)доб-?
Найдём массу воды в первом растворе
m(H2O) =500*(100-4.8)/100=476 г
Зная массу воды и зная массовую долю воды в новом растворе, найдём новую массу раствора
m(нового раствора) =m(H2O) /w(H2O) =476/0.9=528.8(8) г
m(NaCl) =0.1*528.8(8)=52.8(8) г
m(NaCl) =m(NaCl) общ-m(NaCl) нач
m(NaCl) нач=500*4.8/100=24 г
m(NACL) доб=28.8(8) г
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Составим уравнение реакции получения этилена (C2H4) путем дегидратации этилового спирта (C2H5OH):
Учитывая, что молярная масса этилового спирта (C2H5OH) равна 46 г/моль, вычислим химическое количество этилового спирта (C2H5OH) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (C2H5OH) = 92 г/46 г = 2 (моль).
По условию задачи практический выход реакции составляет 33,6 лэтилена. Рассчитаем теоретический выход. Согласно уравнению реакции:
Из 1 моль C2H5OH получено 1 моль C2H4
Из 2 моль C2H5OH получено моль C2H4
Откуда:
Учитывая, что этилен (C2H4) – бесцветный газ, вычислим объем этилена (C2H4), по формуле, устанавливающей связь между объемом и химическим количеством вещества:
Получаем:
V (C2H5OH) = 2 ∙ 22,4 = 44,8 (л).
Итак, теоретический выход реакции составляет 44,8 л.
Найдем выход продукта реакции по формуле:
Получаем:
ответ: выход продукта равен 75%
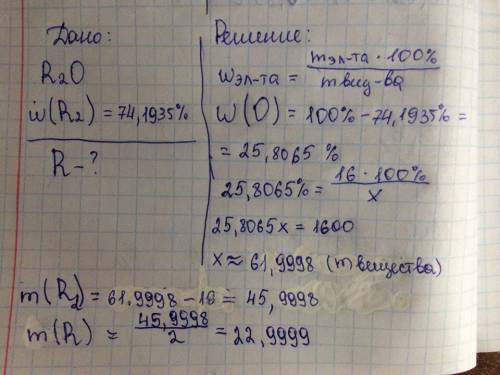
ответ: 28,889 г
Дано:
m₁(р-ну NaCl) = 500 г
ω₁(NaCl) = 4,8%, або 0,048
ω₂(р-ну NaCl) = 10%, або 0,1
m(NaCl)-?
Объяснение:
Для розрахунку приймемо масу солі за х г, тоді
ω₂(р-ну NaCl) = [m₁(р-ну NaCl)*ω₁(NaCl)+x]/[m₁(р-ну NaCl)+x)
0,1 = (500*0,048+х)/(500+х)
0,1 = (24+х)/(500+х)
24+х = 50 + 0,1х
0,9х=26
х= 28,889 (г)
Відповідь: 28,889 г NaCl потрібно додати