Дано:
m(смеси) = 8,9 гр
V(H₂) = 4,48 л
Найти:
ω(Zn) - ?
1) Для начала мы запишем уравнений реакций то что известно по условию задачи:
Zn + 2HCl(изб.) → ZnCl₂ + H₂↑ (1)
Mg + 2HCl(изб.) → MgCl₂ + H₂↑ (2)
2) Далее находим количества вещества у водорода:
Vm = 22,4 л/моль
n(H₂) = V(H₂)/Vm = 4,48 л / 22,4 л/моль = 0,2 моль
3) Теперь находим количества веществ у цинка и у меди, а потом водорода по их реакциям:
Пусть m(Zn) = x гр, тогда m(Mg) = (8,9 - x) гр, следовательно:
M(Zn) = 65 гр/моль M(Mg) = 24 гр/моль
n(Zn) = m(Zn)/M(Zn) = x гр / 65 гр/моль = x/65 моль ⇒ n₁(H₂) = n(Zn) = x/65 моль - из (1) уравнений реакций
n(Mg) = m(Mg)/M(Mg) = (8,9 - x) гр / 24 гр/моль = (8,9 - x)/24 моль ⇒ n₂(H₂) = n(Mg) = (8,9 - x)/24 моль - из (2) уравнений реакций
4) Теперь решаем уравнение:
n₁(H₂) + n₂(H₂) = n(H₂)
x/65 + (8,9 - x)/24 = 0,2 моль | × 1560
24x + 65(8,9 - x) = 312
24x + 578,5 - 65x = 312
24x - 65x = 312 - 578,5
-41x = -266,5 | : (-41)
x = 6,5 гр ⇒ m(Zn) = 6,5 гр
5) Теперь находим массовую долю цинка:
ω(Zn) = m(Zn)/m(смеси) × 100% = 6,5 гр / 8,9 гр × 100% ≈ 0,73 × 100% ≈ 73%
ответ: ω(Zn) = 73%
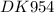
об'єм CO₂ 327,04л.
Объяснение:
Дано:
m(техн.C₅H₁₄) =600г.
ω%(прим)=1,0%
Vm=22,4г./моль
V(CO₂)-?
1. Определим массу примесей в 600г. технического пентана:
m(прим.)= ω%(прим)×m(технC₅H₁₄) ÷ 100%=10%x600г.÷100%=60г.
2. Определяем массу чистого пентана:
m(C₂H₁₄)=m(техн.C₂H₁₄ )-m(прим.)=600г.-60г.=540г.
3. Находим молярную массу пентана и количество вещества n в 540г.:
M(C₂H₁₄)=74г./моль
n₁(C₂H₁₄)=m(C₂H₁₄)÷M(C₂H₁₄)=540г.÷74г./моль=7,3моль
3. Запишем уравнение реакции:
2C₂H₁₄+9O₂=4CO₂+14H₂O
по уравнению реакции:
n(C₂H₁₄)=2моль n(CO₂)=4моль
по условию задачи:
n₁(C₂H₁₄)=7,3моль n₁(CO₂)=14,6моль
4. Определим объем 14,6моль оксида углерода(IV):
V(CO₂)=n₁(CO₂)х Vm
V(CO₂)=14,6моль х22,4л./моль=327,04л.
Массовая доля цинка равна 73.03 %
Объяснение:
Дано:
m(смеси)=8.9 г
V(H2)=4.48 л
Найти
w(Zn)-?
m(смеси)=m(Zn)+m(Mg)=8.9
Zn+2HCl=ZnCl2+H2
Mg+2HCl=MgCl2+H2
M(Mg)=24 г/моль
M(Zn)=65 г/моль
n(Zn)=n(H2)
n(Mg)=n(H2)
n(H2)=V/Vm=4.48/22.4=0.2 моль
n(Zn)*M(Zn)+n(Mg)*M(Mg)=8.9
n(Zn)+n(Mg)=0.2 моль
n(Zn)*M(Zn)+(0.2-n(Zn))*M(Mg)=8.9
n(Zn)*65+0.2*24-n(Zn)*24=8.9
n(Zn)*(65-24)=4.1
n(Zn)=0.1 моль
m(Zn)=0.1*65=6.5 г
w(Zn)=6.5/8.9=0.7303 м.д.=73.03 %