Карбонат аммония используется в качестве пекарского порошка.
При нагревании он разлагается с образованием газообразных
веществ, которые «поднимают» тесто. Вычисли объемы аммиака и
углекислого газа (н. у.), образовавшихся при термическом разложе
нии 9,6 г пекарского порошка
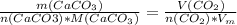 , где
, где
Відповідь:
(NH4)2CO3=2NH3+CO2+H2O
M((NH4)2CO3)=96г/моль
n((NH4)2CO3)=9,6/96=0,1моль
n(NH4)2CO3):nNH3:nCO2=1:2:1
n(NH3)=0,1*2=0,2моль
V(NH3)=22,4*0,2=4,48л
n(CO2)=0,1моль
V(CO2)=22,4*0,1=2,24л
Пояснення: