Дано:
P(смеси) = 202,6 кПа
φ(Cl₂) = 40,7% = 0,407
---------------------------------
Найти:
P(PCl₅) - ?
1) Для начала мы запишем уравнение реакций то что известно из условия задачи:
PCl₅ → PCl₃ + Cl₂
2) По уравнению реакции количество вещества образовавшихся веществ у хлора и трихлорида фосфора к моменту равновесия будут равны:
n(Cl₂) = n(PCl₃)
3) Тогда по закону Авогадро объемы хлора и трихлорида фосфора к моменту равновесия будут тоже самое равны:
V(Cl₂) = V(PCl₃)
4) Объемные доли компонентов газовой смеси к моменту равновесия у образовавшихся веществ у хлора и трихлорида фосфора к моменту равновесия будут равны:
φ(Cl₂) = φ(PCl₃) = 0,407
5) Далее находим объемную долю у хлорид фосфора(V):
φ(PCl₅) = 1 - (φ(Cl₂) + φ(PCl₃)) = 1 - (0,407 + 0,407) = 1 - 0,814 = 0,186
6) Теперь находим парциальное давление PCl₅, по закону парциальных давлений величина парциального давления компонента газовой смеси пропорциональна его объемной доле:
P(PCl₅) = P(смеси) × φ(PCl₅) = 202,6 кПа × 0,186 = 37,6836 кПа ≈ 37,68 кПа
ответ: P(PCl₅) = 37,68 кПа
Решено от : 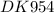
1)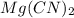 ⇒
⇒ 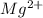 + 2
+ 2 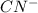
Гидролиз протекает и по катиону и по аниону, т.к соль образована слабым основанием и слабой кислотой.
Протолитическая форма:
Гидролиз по катиону:
Краткое ионное уравнение:
1 ступень: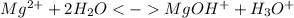
2 ступень:
Гидролиз по аниону:
Молекулярное ур-е: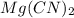 + 2
+ 2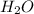 ⇔
⇔ 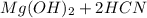 , среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
, среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
2) Rb₂SO₃ ⇒ 2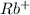 +
+ 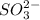
Соль образована сильным основанием и слабой кислотой, гидролиз идет по аниону.
Краткое ионное уравнение гидролиза:
Гидролиз по аниону:
Молекулярное ур-е: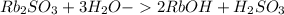
Среда щелочная, т.к в итоге выделились гидроксид ионы, pH>7. Также степень диссоциации основания > степени диссоциации кислоты, из чего можно сделать вывод, что среда - кислая.
3)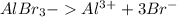
Соль образована слабым основанием и сильной кислотой, поэтому гидролиз идет по катиону.
Протолитическая форма:
Молекулярное ур-е: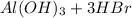
Сокращенное ионное уравнение:
1 ступень: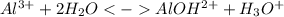
2 ступень: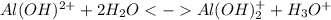
3 ступень: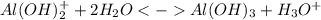
Среда кислая из-за образования ионов гидроксония. Также константа диссоциации основания < степени диссоциации кислоты, это также подтверждает, что среда кислая.
4)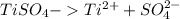
Соль образована слабым основанием и сильной кислотой, гидролиз протекает по катиону:
Протолитическая форма:
Молекулярное ур-е: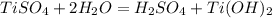
Сокращенное ионное уравнение:
1 стадия: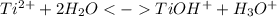
2 стадия: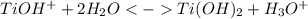
Среда кислая из-за присутствия ионов гидроксония. Также степень диссоциации основания < степени диссоциации кислоты, следовательно среда будет кислая, pH<7.