Значит схема решения задачь таких одинакова:
Запишем формулу для массовой доли вещества в растворе
W = m(чистого вещества) / m(Всего раствора) * 100%
Отсюда находим массу чистого вещества в изначальном растворе
m(чист.) = 150 * 0,1 = 15г
Теперь добавляем к массе этой соли еще 15 грамм, получаем 15 + 15 = 30
Теперь выпариваем воду: из массы раствора вычитаем 45г (1 мл воды весит 1 г ), но помимо этого к массе всего раствора нужно добавить массу добавленной туда соли, итого:
m(всего) = 150-45+15 = 120
Теперь подставляем полученные данные в изначальную формулу:
W = m(чистого вещества) / m(Всего раствора) * 100% = 30 / 120 * 100% = 25%
С водой взаимодействует только сульфид алюминия - с выделением сероводорода.
С кислотой реагирует и Al2S3 и Al.
В последнем случае выделяется и сероводород (в том же кол-ве, что и в реакции с водой), и водород.
Объём водорода - разность объёма смеси газов и объёма сероводорода:
V(H2S) = 6,72 (л)
V(H2) 13,44 - 6,72 = 6,72 (л)
Объёмы газов у нас есть.
Теперь надо определить количество, а затем - массу веществ.
n(H2) = n(H2S) = 6,72/22,4 = 0,3 (моль)
Al2S3 + 6H2O --> 2Al(OH)3 ↓ + 3H2S↑
n(Al2S3) = n(H2S) * 1/3 = 0,1 (моль)
m(Al2S3) = 0,1 * 150 = 15 (г)
2Al + 6HCl --> 2AlCl3 + 3H2
n(Al) = n(H2) * 2/3 = 0,2 (моль)
m(Al) = 27* 0,2 = 5,4 (г)
W(Al) = 5,4/20,4 = 0,2647
или в процентах:
26,47 ~ 26,5 %
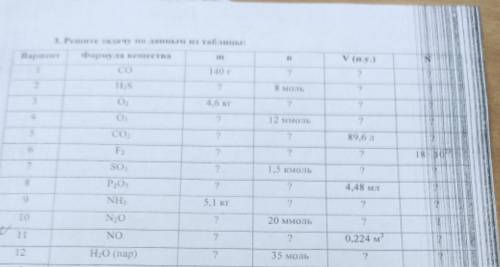
n (NO) = V/Vm = 224 л / 22,4 л/моль = 10 моль = 0,01 кмоль.
m (NO) = M * n = 30 г/моль * 10 моль = 400 г = 0,4 кг.