AlCl3+3KOH(изб)=3KCl+Al(OH)3↓
Дано:
m(р-ра)(AlCl₃) = 136 г
ω(AlCl₃) = 33%
Найти:
m(Al(OH)₃) - ?
1) Найдем количество вещества AlCl₃:ω = (m(в-ва)/m(р-ра))*100% ⇒
m(AlCl₃)(в-ва) = (m(р-ра)*ω)/100% = 136*33/100=44,88 г
M(AlCl₃) = (27+35,5*3) =133,5 г/моль
n(AlCl₃) = m/M = 44,88/133,5 = 0,34 моль
2) Переходим к Al(OH)₃:Т.к KOH в избытке, значит AlCl₃ - в недостатке. Рассчитываем количество молей по AlCl₃.
n(Al(OH)₃) = n(AlCl₃) = 0,34 моль
3) Вычисляем массу Al(OH)₃M(Al(OH)₃) = (27+17) = 44г/моль
m(Al(OH)₃) = n*M = 0,34*44 = 14,96 г
ответ: m(Al(OH)₃) = 14,96 гСоставим уравнение и подпишем под ним то, что дано:
С₂Н₅ОН + Na => C₂H₅ONa + H₂↑
69 г х г
m (Na) = M×n
m (Na) = 22,98 г\моль 1 моль= 22,98 грамм.
m (H₂) = M×n
m (H₂) = 1 г\моль ×2 моль= 2 грамма
Составляем пропорцию:
69 г (Na) - х г (H₂)
22,98 г (Na) - 2 г (H₂)
Отсюда => 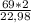 = 6,005 грамм.
= 6,005 грамм.
ответ: 6,005 грамм
Объяснение:
Т.к в уравнении мы имеем один Na, и зная его молярную массу из таблицы Менделеева 22,98 г\моль, то можем найти его массу:
m (Na) = M×n
m (Na) = 22,98 г\моль 1 моль= 22,98 грамм.
Аналогично находим массу водорода
В уравнении у нас H₂, значит количество водорода n=2 моль, молярная масса M(H) = 1 г\моль
m (H₂) = M×n
m (H₂) = 1 г\моль ×2 моль= 2 грамма