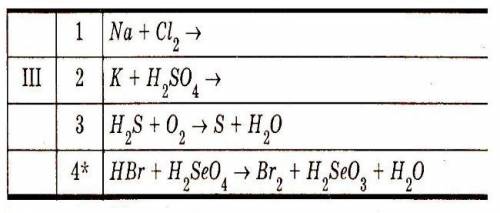
Объяснение:
4K + O2 = 2K2O (соединение)
4Al + 3O2 = 2Al2O3 (соединение)
2Ba + O2 = 2BaO (соединение)
2K + 2H2O = 2KOH + H2 (замещение)
Ba + 2H2O= Ba(OH)2 + H2 (замещение)
Zn + H2O = ZnO + H2 (замещение)
Co + H2O = CoO + H2 (замещение)
Mg + 2HCl = MgCl2 + H2 (замещение)
2Al +3 H2SO4 = Al2(SO4)3 + 3H2 (замещение)
6Na + 2H3PO4 = 2Na3PO4 + 3H2 (замещение)
2Al + 3HgSO4 = Al2(SO4)3 + 3Hg (замещение)
Mg + FeCl2 = MgCl2 + Fe (замещение)
Mg + 2AgCl= MgCl2 + 2Ag (замещение)
Mg + NiSO4 = MgSO4 + Ni (замещение)
Cu +2 AgNO3 = Cu(NO3)2 + 2Ag (замещение)
2Al + 3ZnCl2 = 2AlCl3 + 3Zn (замещение)
3Zn + 2FeCl3 = 3ZnCl2 + 2Fe (замещение)
В оксиде железа III железо имеет степень окисления +3, следовательно, он будет растворяться в кислотах
Fe2O3 + 6HCl —> 2FeCl3 + 3H2O
Гидроксиды металлов образуются при взаимодействии их солей с щелочами
FeCl3 + 3NaOH —> Fe(OH)3 + 3NaCl
Более активные металлы могут восстанавливать менее активные
2Fe(OH)3 + 2Al —> 2Fe + Al2O3 + 3H2O
Железо растворяется в разбавленной серной кислоте с образованием сульфата железа 2. Если бы кислота была концентрированная, то образовался бы хлорид железа 3
Fe + H2SO4 —> FeSO4 + H2
FeSO4 + 2NaOH —> Fe(OH)2 + Na2SO4
Во влажном воздухе гидроксид железа 2 окисляется кислородом
4Fe(OH)2 + O2 + 2H2O —> 4Fe(OH)3