ответ:Число общих электронных пар между связанными атомами характеризует кратность связи. [2]
По числу общих электронных пар химические связи подразделяются на одинарные) и кратные - двойные и тройные. [3]
По числу общих электронных пар химические связи подразделяются на ординарные) и кратные - двойные и тройные. Если между двумя атомами одинаковой или различной химической природы возникает только одна ковалентная связь, то ее называют или ординарной, связью. Сигма-связь образуется в результате взаимодействия двух s - электро-нов, двух / з-элект ронов, а также двух смешанных s - и р-электронов. На рис. 14 изображены о-связи в некоторых элементарных и сложных веществах. [4]
Валентность элемента в соединениях с ковалентной связью определяется числом общих электронных пар, которые атом элемента образует с атомами других элементов. [5]
Валентность элемента в соединениях с ковалентной связью определяется числом общих электронных пар. [6]
В соединениях с ковалентной связью валентность элемента определяется числом общих электронных пар. Атом, к которому смещена электронная пара, обладает отрицательной валентностью, а противоположный атом - положительной валентностью. [7]
Степень окисления элемента в молекуле с ковалентной связью равна числу общих электронных пар. Так, в молекуле аммиака атом азота образует с атомами воДорода три общие электронные пары, следовательно, валентность азота равна трем. [8]
Для многоатомных частиц типа SO2, СО2, SO, SO и С8Ыв, в которых п-связи предпочтительнее рассматривать как многоцентровые и делокализо-ванные, подсчет числа общих электронных пар для отдельных атомов теряет свой смысл, а число валентностей ничего не говорит о ковалентиости атомов. [9]
Одиночные ( или неспаренные) электроны в электронных оболочках атомов, за счет спаривания которых возникает химическая связь в молекулах, называют валентными. Число общих электронных пар, образующихся при взаимодействии атомов химических элементов, определяет их валентность. [10]
По методу валентных связей, в котором все ковалентные связи рассматриваются как двухцентровые, ковалентность атома - это число общих электронных пар, образуемых данным атомом. [11]
В органических соединениях СН4, С2Н4, С2Н2 атом углерода четырехвалентен. Для многоцентровых частиц, например S02, C02, S047 SO, C6H6 в которых л-связи предпочтительное рассматривать как многоцентровые и делокализованные, подсчет числа общих электронных пар для отдельных атомов теряет свой смысл, и число валентностей ничего не говорят о ковалентности атомов. [12]
Из приведенных схем видно, что каждая электронная пара соответствует одной единице валентности. Химическая связь, осуществляемая парой общих электронов, называется ковалент-ной, или атомной, связью. Валентность элемента в соединениях с ковалентной ( атомной) связью определяется числом общих электронных пар. [13]
Валентность элемента в настоящее время рассматривается как число ковалентных связей его атома в данном соединении, современные синонимы этого термина - ковалентность, связность. Именно в ковалентной химической связи проявляется высокая химическая специфичность каждого элемента и каждого его валентного состояния: специфичность энергии связи, степени полярности и стереометрических характеристик - углов связи, их длин. Ионная связь менее специфична; она собственно становится связью только в конденсированных фазах, главным образом в твердых телах, в которых кристаллические структуры ионных веществ довольно однообразны и определяются зарядами и размерами ионов. Поэтому нельзя априорно определять валентность по числу неспаренных электронов в основном состоянии атома, как это иногда делается; валентность определяется числом общих электронных пар между данным атомом и соединенными с ним атомами.
Второе положение теории химического строения. Свойства органических веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением. Изомерами называют вещества, имеющие одинаковый качественный и количественный элементный состав, но различное химическое строение, а следовательно, и различные свойства.
Этиламин и диметиламин имеют одинаковый качественный и количественный состав (C2H7N), но имеют различное химическое строение, соответственно эти вещества являются изомерами.
Этиламин имеет аммиачный запах, а диметиламин рыбный запах, это связано с тем, что данные вещества имеют различный порядок соединения атомов в молекуле, следовательно, имеют различные свойства.
Источник: https://gomolog.ru/reshebniki/10-klass/gabrielyan-2019/2/2.html
Объяснение:
Перейди по ссылке выше и там ещё схемы будут.
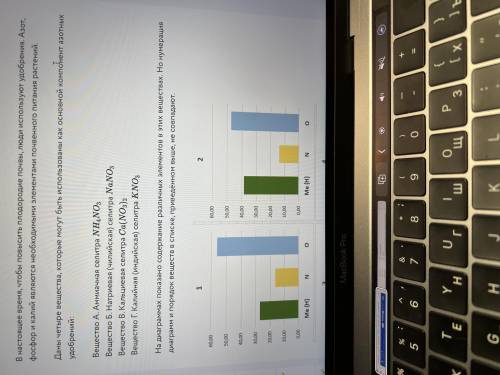
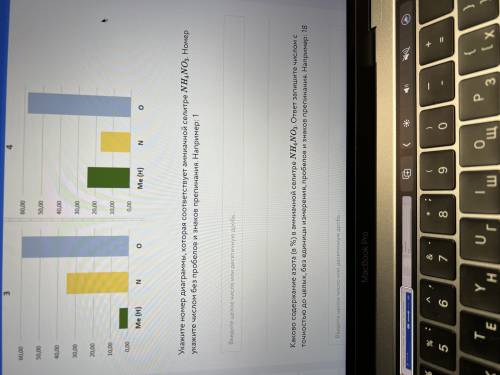
1)Me
2)O
3)Б,Г
Я надеюсь, правильно