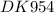Всё верно, есть мелкие недочеты:
Во втором неправильный оксид алюминия,
В третьем нет коэффициента перед водой,
Четвертое уравнение (гидролиз сульфита меди) неверное.
Ионные формы:
1) Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 2Na[+] + 2OH[-] → 2Na[+] + 2AlO2[-] + H2O
Al2O3 + 2OH[-] → 2AlO2[-] + H2O
2) Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 6H[+] + 6Cl[-] → 2Al[3+] + 6Cl[-] + 3H2O
Al2O3 + 6H[+] → 2Al[3+] + 3H2O
3) 2HCl + Zn(OH)2 → ZnCl2 + 2H2O
2H[+] + 2Cl[-] + Zn(OH)2 → Zn[2+] + 2Cl[-] + 2H2O
2H[+] + Zn(OH)2 → Zn[2+] + 2H2O
4) CuSO3 + 2H2O → CuО + H2SO3
СuSO3 + 2H2O → CuO + 2H[+] + SO3[2-]
5) Al2(CO3)3 + 3H2O → 2Al(OH)3 + 3CO2↑
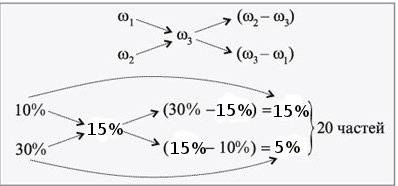
1)Эта задача на растоворы удобно решается ч-з конверт Пирсона.Смотри приложенное изображение.
Для приготовления 300г 15%-го раствора соли, нужно взять 20(15 и 5) частей исходной концентрации.
Проверка: 300/20=15
m 10%-го р-ра= 15*15=225(г)
m 30%-го р-ра=15*5=75(г)
225г 10%-го раствора --- х(г) соли
100г 10%-го раствора --- 10г соли
х=22,5 г
75г 30%-го раствора --- х(г)соли
100г 30%-го раствора --- 30г соли
х=22,5
m(соли)=22,5+22,5=45(г)
m(полученного 15%-го раствора)=225+75=300(г)
Находим w3: 300г раствора ---- 45г соли
100г раствора ---- w3 г соли
w3=100*45/300= 15г или 15% => задача решена верно.
ответ: 225 г 10%-го раствора и 75 г 30%-го раствора.
2
М (CuSO4 ∙ 5Н2О) = 250 г/моль
М (CuSO4) = 160 г/моль
250 г. CuSO4 ∙ 5Н2О - 160 г. CuSO4
25 г. - х г.
х = 25 г. ∙ 160 г. / 250 г. = 16 г.
m р.ра = mр. в. ∙ 100% / ω
m р.ра = 16 г. / 0,04 = 400 г.
m (Н2О) = 400 г. – 25 г. = 375 г.
ответ: m (Н2О) = 375 г.
Решение представлен в этом документе:
Решено от: