а)
1) 2Na + O2 = Na2O2
Реакция соединения.
(в-ль) 2 Na(0) - 2 e- → 2 Na(1) (окисление)
(о-ль) 2 O(0) + 2 e- → 2 O(-1) (восстановление)
2) 2Na + Na2O2 = 2Na2O
Реакция соединения.
(в-ль) 2 Na(0) - 2 e- → 2 Na(1) (окисление)
(о-ль) 2 O(-1) + 2 e- → 2 O(-2) (восстановление)
3) Na2O + H2O = 2NaOH
Реакция соединения.
4)
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
Реакция обмена.
б) 2Na + 2H2O = 2NaOH + H2
Реакция замещения.
(в-ль) 2Na(0) - 2 e- → 2 Na(1_ (окисление)
(о-ль) 2H(1) + 2 e- → 2 H(0) (восстановление)
H2S + 2NaOH = Na2S + 2H2O
Реакция замещения.
Na2S + Cl2 = S + NaCl
Реакция соединения.
2NaCl + SO4 = Na2SO4 + 2Cl
Реакция разложения.
2 г х л у моль z моль
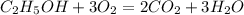
46 г 67,2 л 2 моль 3 моль
1. Найдем объем кислорода:
для полного взаимодействия 46 г спирта необходимо 67,2 л кислорода, а
для -- // -- 2 г___________________х л, откуда
х=2*67,2/46=2,9 л
2. Определим количество вещества углекислого газа:
при взаимодействии 46 г спирта выделяется 2 моль углекислого газа, а
при -- // -- 2 г__________________у моль, откуда
у=2*2/46=0,09 моль
3. Рассчитаем количество вещества воды:
при взаимодействии 46 г спирта образуется 3 моль воды, а
при -- // -- 2 г_________________z моль, откуда
z=2*3/46=0,13 моль
Химические свойства
1. Кальций — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. Кальций взаимодействует с азотом при 200 — 450º С образуя нитрид кальция:
3Ca + N2 = Ca3N2
1.2. Кальций сгорает в кислороде (воздухе) при выше 300º С с образованием оксида кальция:
2Ca + O2 = 2CaO
1.3. Кальций активно реагирует при температуре 200 — 400º С с хлором, бромом и йодом. При этом образуются соответствующие соли:
Ca + Br2 = CaBr2
Ca + Cl2 = CaCl2
Ca + I2 = CaI2
1.4. С водородом кальций реагирует при температуре 500 — 700º C с образованием гидрида кальция:
Ca + H2 = CaH2
1.5. В результате взаимодействия кальция и фтора при комнатной температуре образуется фторид кальция:
Ca + F2 = CaF2
1.6. Кальций взаимодействует с серой при 150º С и образует сульфид кальция:
Ca + S = CaS
1.7. В результате реакции между кальцием и фосфором при 350 — 450º С образуется фосфид кальция:
3Ca + 2P = Ca3P2
1.8. Кальций взаимодействует с углеродом (графитом) при 550º С и образует карбид кальция:
Ca + 2C = CaC2
2. Кальций активно взаимодействует со сложными веществами:
2.1. Кальций при комнатной температуре реагирует с водой. Взаимодействие кальция с водой приводит к образованию гидроксида кальция и газа водорода:
Ca + 2H2O = Ca(OH)2↓ + H2↑,
2.2. Кальций взаимодействует с кислотами:
2.2.1. Кальций реагирует с разбавленной соляной кислотой, при этом образуются хлорид кальция и водород:
Ca + 2HCl = CaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой кальций образует нитрат кальция, оксид азота (I) и воду:
4Ca + 10HNO3= 4Ca(NO3)2 + N2O↑ + 5H2O,
если азотную кислоту еще больше разбавить, то образуются нитрат кальция, нитрат аммония и вода:
4Ca + 10HNO3 = 4Ca(NO3)2 + NH4NO3 + 3H2O
2.3. Кальций вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид кальция и гидрид кальция:
6Ca + 2NH3 = Ca3N2 + 3CaH2,
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид кальция и водород:
Ca + 2NH3 = Ca(NH2)2↓ + H2↑