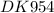Na2CO3 + 2AgNO3 → Ag2CO3 + 2NaNO3
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Cu + 2HCl → CuCl2 + H2 Реакция протекает при температуре 600-700°C.
AgNO3 + HCl → AgCl + HNO3
2AgNO3 + 2KOH → Ag2O + 2KNO3 + H2O Гидроксид калия - разбавленный раствор
AgNO3 + KOH → AgOH + KNO3 Реакция протекает в этаноле при температуре около -50°C.2AgNO3 + Fe → Fe(NO3)2 + 2Ag
BaO + 2HCl → BaCl2 + H2O
2KOH + 2HCl → 2KCl + H2O
Fe + 2HCl → FeCl2 + H2
BaO + H2O → Ba(OH)2
BaO + CO2 → BaCO3
CO2 + H2O ⇄ H2CO3
3Fe + 4H2O → Fe3O4 + 4H2 Реакция протекает при температуре не более 570°C
KOH + CO2 → KHCO3 Реакция идет в этаноле
2KOH + CO2 → K2CO3 + H2O Гидроксид калия - концентрированный раствор
Fe + CO2 ⇄ FeO + CO
Відповідь:
начальная скорость хим. реакции = произведению концентраций исходных веществ (только газообразных), взятых в степенях, соответствующих их коэффициенту, т.е. скорость = концентрация CH4 умнож. на концентрацию O2 в квадрате (т.к. коэффициент перед кислородом 2)
При увеличении давления в 6 раз увеличивается концентрация реагирующих веществ. Вынося из скобок коэффициенты 6, также возводим их в степень, соответствующую коэффициенту перед веществом.
Далее относим получившуюся скорость реакции к начальной. То, что в скобках, сокращается, и получаем 216. Т.е. скорость реакции возрастет в 216 раз
Пояснення:
Дано:
[Mg²⁺] = 1,8×10⁻⁵ моль/л
[Zn²⁺] = 2,5×10⁻² моль/л
-------------------------------------------
Найти:
ЭДС - ?
1) Для нахождения ЭДС гальванического элемента рассчитывается п формуле:
ЭДС = E(катод) - E(анод)
2) Далее концентраций ионов находим в табличном значений про стандартных электродных потенциалов:
E°(Mg²⁺/Mg) = -2,37 В E°(Zn²⁺/Zn) = -0,763 В
3) Далее мы их находим электродные потенциалы по уравнению Нернста:
E(Mg²⁺/Mg) = -2,37 В + 0,059 / 2 × lg(1,8×10⁻⁵) ≈ -2,37 В + 0,0295 × (lg 1,8 + lg 10⁻⁵) ≈ -2,37 В + 0,0295 × (0,25 + (-5)) ≈ -2,37 В + 0,0295 × (0,25 - 5) ≈ -2,37 В + 0,0295 × (-4,75) ≈ -2,37 В + (-0,140125) ≈ -2,37 В - 0,140125 ≈ -2,510125 В ≈ -2,51 В
E(Zn²⁺/Zn) = -0,763 В + 0,059 / 2 × lg(2,5×10⁻²) ≈ -0,763 В + 0,0295 × (lg 2,5 + lg 10⁻²) ≈ -0,763 В + 0,0295 × (0,40 + (-2)) ≈ -0,763 В + 0,0295 × (-1,6) ≈ -0,763 В + (-0,0472) ≈ -0,763 В - 0,0472 ≈ -0,8102 В ≈ -0,81 В
4) В результате полученных мы получаем что Е(Zn²⁺/Zn) > Е (Mg²⁺/Mg), т.е. катод - Zn , а анод - Mg.
5) Теперь находим ЭДС гальванического элемента:
ЭДС = E(катод) - E(анод) = E(Zn²⁺/Zn) - E(Mg²⁺/Mg) = -0,81 В - (-2,51 В) = -0,81 В + 2,51 В = 1,70 В
ответ: ЭДС = 1,70
Решено от :