1. Неметаллические свойства у кремния выражены сильнее,чем у:
3) алюминия
*Неметаллические и окислительные свойства возрастают слева направо по группам и снизу вверх по периодам.
2. Одинаковую степень окисления атомы хлора имеют в соединениях:
1) Cl2O7 и HClO4
*Cl2(+7)O7(-2), H(+)Cl(+7)O4(-2)
3. К хорошо растворимым в воде электролитам относится каждое из двух веществ:
2) MgCl2 и MgSO4
*MgCl2 -> Mg(2+) + 2Cl(-)
MgSO4 -> Mg(2+) + SO4(2-)
4.В реакцию с раствором серной кислоты вступает:
2)нитрат бария
*H2SO4 + Ba(NO3)2 -> BaSO4⬇️ + 2HNO3
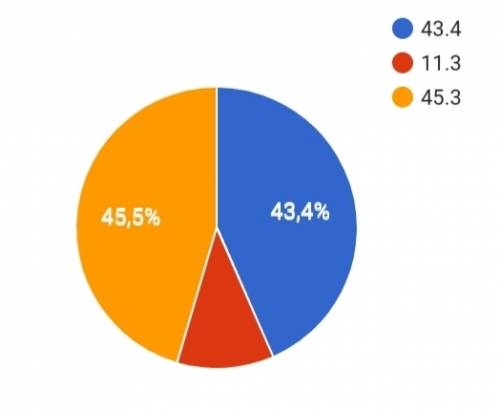
5 Mr(Na2CO3)=23×2+12+48=106
w(Na)=(46/106)×100%=43.4%
w(C)=(12/106)×100%=11.3%
w(O)=(48/106)×100%=45.3%
Дано: m (сахара) = 40 г V (воды) = 160 см 3 ;
Найти: ω (сахара) -?
И .
Из формулы ρ = m / V находим массу воды
m (воды) = ρ (воды) • V (воды) = 1 г / см 3 • 160 см 3 = 160 г.
Видим, что для воды масса совпадает с объемом, поэтому это действие не является обязательным.
Находим массу раствора.
m (раствора) = m (сахара) + m (воды) = 40 г + 160 г = 200 г.
Вычисляем массовую долю сахара в растворе по формуле:
ω (сахара) = m (сахара) / m (раствора) = 40 г / 200 г = 0,2 или 20%.
ИИ образом.
Из формулы ρ = m / V находим массу воды
m (воды) = ρ (воды) • V (воды) = 1 г / см 3 • 160 см 3 = 160 г.
Видим, что для воды масса совпадает с объемом, поэтому это действие не является обязательным.
Находим массу раствора.
m (раствора) = m (сахара) + m (воды) = 40 г + 160 г = 200 г.
Определяем массу вещества, содержащегося в 100 г раствора, то есть, массовую долю сахара в растворе. для
этого составляем пропорцию и решаем ее:
в 200 г раствора содержится 40 г сахара, тогда
в 100 г раствора будет содержаться х г сахара
200 г / 100 г = 40 г / х г,
поэтому х г • 200 г = 40 г • 100 г,
х = (40 г • 100 г): 200 г = 20 г, поэтому
ω (сахара) = 20%
ответ: ω (сахара) = 20% или 0,2.